
分析 铜、锌和稀盐酸组成的原电池中,根据金属的活泼性判断正负极,根据得失电子判断发生反应的反应类型并写出相应的电极反应式.
解答 解:在铜、锌和稀盐酸组成的原电池中,锌的活泼性大于铜,所以铜作正极,铜上氢离子得电子反应还原反应生成气体 2H++2e-=H2↑;锌作负极,锌失电子变成阳离子进入溶液,发生氧化反应,电极反应式为 Zn-2e-=Zn2+.
故答案为:正; 还原; 2H++2e-=H2↑;负; 氧化; Zn-2e-=Zn2+.
点评 本题考查了原电池工作原理中正负极的判断、电极反应的反应类型、电极反应式的书写,正负极的判断中不能单纯根据金属的活泼性判断,要依据发生反应的反应类型判断.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3溶液在空气中加热蒸干并灼烧后,可以得到Fe2(SO4)3 | |
| B. | 为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下,加入氨水,过滤后向滤液中再加入适量盐酸 | |
| C. | 配制FeSO4溶液时,为了抑制亚铁离子水解,需加入少量Fe | |
| D. | 室温下,向PH=4的醋酸溶液中加入等体积的PH=10的NaOH溶液,反应后溶液呈碱性,是因为生成了强碱弱酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO2和SO3的混合物中硫原子数为0.5NA | |
| B. | 1 mol N2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA | |
| D. | 常温常压下,7.8 g Na2O2含有的阴离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 为了防止龋齿,人人都要使用含氟牙膏 | |
| C. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| D. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.68 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
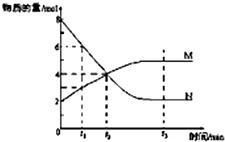 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2++CO32-+2H+=Ba(NO3)2+H2O+CO2↑ | |
| B. | BaCO3+2H+=Ba2++H2O+CO2↑ | |
| C. | BaCO3+2H++2NO3-=Ba(NO3)2+H2O+CO2↑ | |
| D. | CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com