
| A. | 生成氢气是HCl溶液多 | |
| B. | 生成氢气是CH3COOH溶液多 | |
| C. | 反应速率是HCl溶液与锌反应的快 | |
| D. | 反应速率是CH3COOH溶液与锌反应的快 |
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:解答题
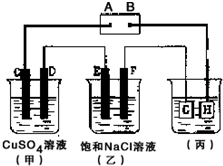 如图所示的装置,C、D、E、F 都是惰性电极.将电源接通后,观察到甲中C电极上有红色固体析出,电解一段时间后,C电极质量增加19.2g,试回答以下问题:
如图所示的装置,C、D、E、F 都是惰性电极.将电源接通后,观察到甲中C电极上有红色固体析出,电解一段时间后,C电极质量增加19.2g,试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
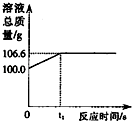 将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:
将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逐渐增大 | B. | 逐渐减小 | ||
| C. | 先逐渐增大后减小 | D. | 先逐渐减小后增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 | |
| B. | 铜片与稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O | |
| C. | Fe2(SO4)3的酸性溶液中通入足量硫化氢Fe3++H2S=Fe2++S↓+2H+ | |
| D. | 在碳酸氢钙溶液中加入过量氢氧化钠溶液Ca2++HCO3-+OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3 | B. | PCl3 | C. | NO3- | D. | BCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com