
| A. | 准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol•L-1的NaOH标准溶液 | |
| B. | 催化剂可以加快化学反应速率但不能改变化学反应的焓变 | |
| C. | 100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 | |
| D. | 对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
分析 A.氢氧化钠固体易潮解,氢氧化钠溶液容易与空气中的二氧化碳反应,所以无法配制0.1000mol•L-1的NaOH标准溶液;
B.催化剂对化学平衡无影响;
C.弱电解质酸性越弱,电离程度越小,相同pH时需要的浓度越大,据此进行判断;
D.化学平衡常数只受温度影响,温度不变,化学平衡常数不变.
解答 解:A.氢氧化钠溶液容易与空气中的二氧化碳反应而导致变质,即使称量出0.4000g氢氧化钠固体,最后配制的溶液中,氢氧化钠的浓度也不是0.1000mol/L,故A错误;
B.化学反应中,催化剂只影响反应速率,催化剂对化学平衡无影响,不会改变反应物的转化率,所以不会影响化学反应的焓变,故B正确;
C.100mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB的物质的量比HA的物质的量大,而电离出的氢离子却相同,说明了HB的酸性比HA的弱,故C正确;
D.对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,由于温度不变,所以平衡常数K不会变化,故D错误;
故选BC.
点评 本题考查了配制一定物质的量浓度的溶液的方法、弱电解质酸性强弱判断、化学平衡影响因素等知识,题目难度中等,注意明确影响化学平衡的因素,掌握判断弱电解质酸性强弱的方法.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
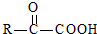 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$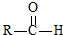 +H2O
+H2O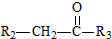 $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$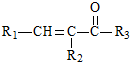 +H2O
+H2O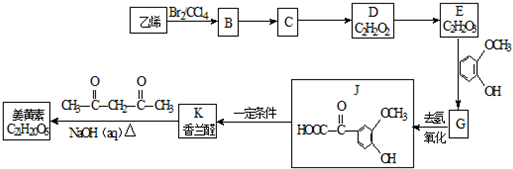
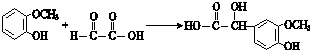 .
.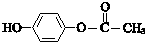
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲的摩尔体积比乙的摩尔体积小 | |
| B. | 甲的物质的量比乙的物质的量多 | |
| C. | 甲的相对分子质量比乙的相对分子质量小 | |
| D. | 甲的分子数比乙的分子数少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都伴随着能量的变化 | |
| B. | 升高温度或加入催化剂,可以改变化学反应的反应热 | |
| C. | 化学反应中的能量变化都是以热量的形式体现 | |
| D. | 2CO(g)+O2(g)═2CO2(g)△H<0,则56g CO和32g O2所具有的总能量小于88g CO2所具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
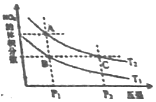 反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点的化学平衡常数:A>C | |
| C. | A、C两点N2O4的转化率:A>C | |
| D. | 由状态B到状态A,可以用加热的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在镀件上电镀锌,用锌作阳极 | |
| B. | 电解法精炼粗铜,用纯铜作阴极 | |
| C. | 电解饱和食盐水制氯气,用涂镍碳钢网作阴极 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com