
【题目】下列与含氯化合物有关的说法正确的是
A. HClO是弱酸,所以NaClO是弱电解质
B. 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C. 六水合氯化钙可用作食品干燥剂
D. 氯化铵、漂白粉都属于强电解质
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是Na202和C02定性、定量实验的装置示意图。
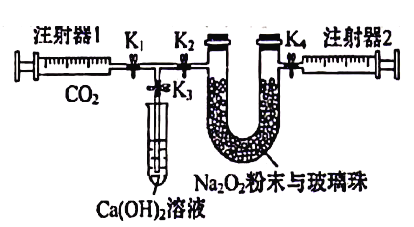
注射器1中抽取了100mL CO2,U型管中装有适量小玻璃珠和约1.5g Na2O2粉末。实验开始时,打开K1、K2、K4止水夹,关闭K3止水夹,推动注射器1活塞,缓缓将CO2压至U型管,注射器2活塞缓缓向外移动。下列叙述中不正确的是
A. U形管内的玻璃珠可防止过氧化钠粉末被吹和增大过氧化钠和二氧化碳的接触面积
B. U形管内淡黄色粉末渐渐变白
C. 注射器1活塞推到底后,注射器2中收集到的气体大于50mL,只是因为还含有CO2
D. 打开胶塞,立即将带火星的木条伸入U形管中,可验证反应产物之一为氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有1molHNO3和1molH2OS4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是()
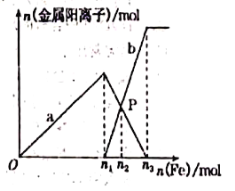
A. a表示n(Fe3+)的变化曲线
B. n1=0.75
C. P点时,n(Fe2+)=0.5625 mol
D. 向P点溶液中加入铜粉,最多可溶解14.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga 基态原子核外电子排布式为 ____,As 基态原子核外有_________个未成对电子。
(2)Ga、As、Se 的第一电离能中大到小的顺序是 __________,Ga、As、Se 的电负性由大到小的顺序是 ____。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:_____。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3 的熔点超过 1000 ℃,可能的原因是 _____________。
(4)二水合草酸镓的结构如图 1 所示,其中镓原子的配位数为_____,草酸根中碳原子的杂化轨道类型为 ____。
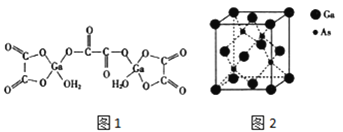
(5)砷化镓的立方晶胞结构如图 2 所示,晶胞参数为 a=0.565nm,砷化镓晶体的密度为_____g/ cm3(设 NA为阿伏加德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物 W 对肝癌的治疗具有很好的效果,一种合成药物 W 的路线如下:
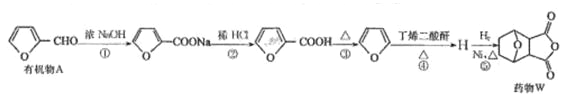
已知以下信息:
①2HCHO +NaOH→CH3OH+ HCOONa
②![]()
③丁烯二酸酐的结构筒式为![]()
回答下列问题:
(1)有机物 A 中含有的官能团有碳碳双键、_____(填名称)。
(2)第①步反应中除生成![]() 外,还生成另一产物,此产物的结构简式为_____。
外,还生成另一产物,此产物的结构简式为_____。
(3)H 的结构简式为_____。
(4)第⑤步的反应类型是_____。
(5)L 是药物 W 的同分异构体,同时满足下列条件的 L 有 _____种(不考虑立体异构);
①分子中含有苯环,苯环上,有 4 个取代基
②既能与 FeCl3,溶液发生显色反应,又能与 NaHCO3,溶液反应生成气体
③1mol能与 3 mol NaOH 完全反应,其中核磁共振氢谱为四组峰,峰面积比为 1:2:2:3 的结构简式为 ____。
(6)写出由![]() 制备丁烯二酸酐
制备丁烯二酸酐![]() 的合成路线:_____其他试剂任选)。
的合成路线:_____其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图 1 所示装置制备 KClO 溶液,并通过 KClO 溶液与 FeCl3 溶液的反应制备高效水处理剂K2FeO4。已知 K2FeO4 具有下列性质: ①可溶于水,微溶于饱和 KOH 溶液;②在 0~5 ℃的强碱性溶液中比较稳定;③在 Fe3+和 Fe(OH)3 催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成 Fe(OH)3 和 O2。
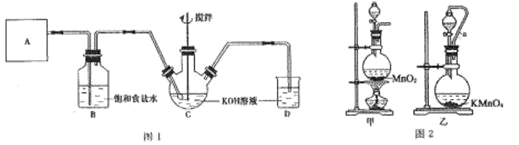
回答下列问题:
(1)装置A 用于产生氯气,若选用图 2 中的甲装置,反应的离子方程式是_____,若选用装置乙,其中的导管 a 的作用是_____。
(2)Cl2 与 KOH 在较高温度下反应生成 KClO3。在不改变 KOH 溶液的浓度和体积的条件下,控制反应在0--5℃进行。实验中可采取的措施是_____;在通入氯气的过程中,不断搅拌的目的是_____。
(3)制备 K2FeO4 时,KClO 饱和溶液与 FeCl3 饱和溶液的混合方式为_____,反应的离子方程式是_____。
(4)提纯 K2FeO4 粗产品[ 含有 Fe(OH)3、KCl 等杂质]的实验方案为:将 K2FeO4 粗产品溶于冷的3 mol/LKOH 溶液中__________(填操作名称),将滤液置于冰水浴中,再加入_________,搅拌、静置、再过滤,晶体用适量乙醇洗涤 2--3 次后,在真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.
根据图示回答下列问题:

(1)写出A、B、C、D、E的结构简式:A_____,B_____,C_____,D_____,E_____;
(2)写出②、④两步反应的化学方程式:
②_________________________________;
④__________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为672 mL的烧瓶中充满NO和NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且液体充满烧瓶(气体体积都已折合为标准状况下的体积),下列有关叙述正确的是( )
A. 总反应为NO+NO2+O2+H2O===2HNO3
B. 总反应为4NO+8NO2+5O2+6H2O===12HNO3
C. 生成硝酸的物质的量浓度均为0.030 mol·L-1
D. 生成硝酸的物质的量浓度约为0.060 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com