
【题目】实验室需配制0.10 mol·L-1 NaCl溶液250 mL。
(1)容量瓶上需要标有_________。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸(碱)式
(2)按下列操作步骤填上适当的文字,以使整个操作完整。
第一步:选择仪器。完成本实验所必需的仪器有:
天平(精确到0.1 g)、药匙、_____、_____、_____、_____以及等质量的两片纸。
第二步:计算。配制该溶液需取NaCl晶体______g。
第三步:称量。
①天平调平之后,应将天平的游标调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:______
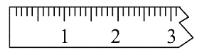
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入________中。
第四步:__________,该步实验中还需进行的动手操作是: _________________________________
第五步:转移、洗涤。
第六步:_____________________________________。
第七步: ____________________________________。
第八步:将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、名称及浓度。
(3)定容摇匀后,某同学发现液面略低于刻度线,又用蒸馏水添加至刻度线。该操作是否会对所配制的溶液浓度造成影响?为什么?_______________。
【答案】①③⑤ 烧杯 玻璃棒 250mL容量瓶 胶头滴管 1.5 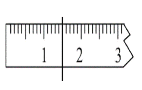 左盘 烧杯 溶解冷却 用玻璃帮搅拌 定容 摇匀 会使得浓度偏低,定容摇匀后静止,发现液面低于刻度线是正常的,再加蒸馏水至刻度线,相对于稀释,使浓度偏低
左盘 烧杯 溶解冷却 用玻璃帮搅拌 定容 摇匀 会使得浓度偏低,定容摇匀后静止,发现液面低于刻度线是正常的,再加蒸馏水至刻度线,相对于稀释,使浓度偏低
【解析】
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;根据实验操作的步骤;
(3)根据![]() 分析操作对浓度的影响。
分析操作对浓度的影响。
(1)容量瓶上标有温度、容量、刻度线,故选:①③⑤;
(2) 第一步:配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以来需要的仪器为:烧杯、玻璃棒、250mL容量瓶、胶头滴管;
第二步:配制0.10 mol·L-1 NaCl溶液250 mL,需要NaCl的质量m=cVM=0.10mol·L-1×0.25L×58.5g·mol-1=1.4625g,由于托盘天平只能称量到小数点后1位,因此应该称量1.5g;
第三步:①可不用砝码,直接用游码表示1.5g,游码位置如图 ;
;
②称量时,应该遵循“左物右码”,NaCl晶体应放于天平的左盘;
③称量时,NaCl应先用烧杯溶解;将药品倒入烧杯中;
第四步:溶解冷却,需要用玻璃帮搅拌,加快溶解;
第六步:定容,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,直到凹液面的最低处与刻度线水平;
第七步:摇匀,盖好玻璃塞,上下颠倒容量瓶,使溶液混合均匀;
(3)会使得浓度偏低,定容摇匀后静止,发现液面低于刻度线是正常的,再加蒸馏水至刻度线,相对于稀释,使浓度偏低。


科目:高中化学 来源: 题型:
【题目】常温下,不能证明乙酸是弱酸的实验事实是
A.0.1mol·L-1CH3COOH溶液pH>1
B.pH=1CH3COOH溶液稀释100倍,pH<3
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1mol·L-1CH3COONa溶液的pH大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液所得滴定曲线如图。下列说法正确的是
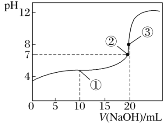
A.点①所示溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(OH-)=c(CH3COOH)+c(H+)
D.滴定中可能出现:c(CH3COO-)>c(H+)>c(OH-)>c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有73 g HCl气体,若阿伏加德罗常数用NA表示,则:
(1)HCl气体的物质的量为_______mol。
(2)HCl气体所含原子总数为_______个。
(3)HCl气体在标准状况下的体积为________L。
(4)HCl气体溶于水后形成2 L溶液,其溶液的物质的量浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以某软锰矿(主要成分为MnO2,还含有SiO2、Al2O3等杂质)为原料,利用烟道气中的SO2制备MnSO4·H2O的流程如下:
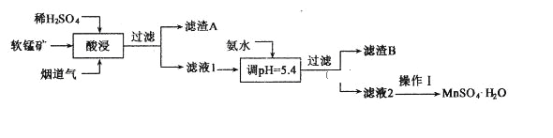
下列说法不正确的是
A. 滤渣A的主要成分能导电,可制备光导纤维
B. “酸浸”主要反应的离子方程式为MnO2+SO2=Mn2++SO42-
C. 加氨水调节pH的目的是除Al3+
D. 操作I为结晶、过滤、洗涤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲线如图。下列说法不正确的是( )
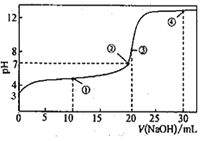
A.弱酸HA的电离平衡常数数量级为10-5
B.点①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.点③所示的溶液中:c(H+)+c(HA)>c(OH-)
D.点④所示的溶液中2c(OH-)-2c(H+)=c(A-)+3c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )
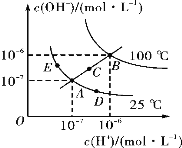
A.图中三点对应水电离出氢离子浓度关系:E<A<D
B.若从A点到E点,可采用温度不变,向水中加入适量的NaAc固体
C.图中三点对应离子积关系:B>C>A
D.当处在B点时,将pH=3的硫酸与pH=11的KOH溶液等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10—10),下列说法正确的是
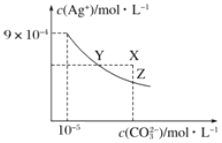
A.根据图示可计算出Ksp(Ag2CO3)=9×10—9
B.向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点
C.反应Ag2CO3(s)+2Cl—(aq)![]() 2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108
2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108
D.将0.001mol/LAgNO3溶液滴入浓度均为0.001mol/L的KCl和K2CO3的混合溶液,CO32—先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com