
| ||
| ||


科目:高中化学 来源: 题型:
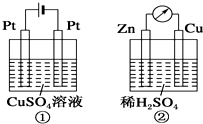 如图所示的两个装置中,溶液的体积 均为200mL,开始时电解质溶液的浓度均为0.1mol/L.工作一段时间后,测得导线中均通过0.02mol电子.若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个装置中,溶液的体积 均为200mL,开始时电解质溶液的浓度均为0.1mol/L.工作一段时间后,测得导线中均通过0.02mol电子.若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A、产生气体的体积:①>② |
| B、溶液的pH变化:①增大,②减小 |
| C、电极上析出固体物质的质量:①>② |
| D、电极反应式:①的阴极:Cu2++2e-═Cu,②的负极:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
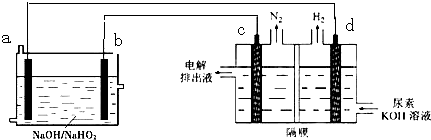
| A、燃料电池总反应为:3HO2-+2Al=OH-+2AlO2-+H2O |
| B、电极b是正极,且反应后该电极区pH增大 |
| C、每消耗27g Al,理论上产生11.2L(标准状况下)氮气 |
| D、反应时,电子的流向为:a→b→c→d. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 液态HCl
液态HCl NaOH固体
NaOH固体 Na2SO4?10H2O
Na2SO4?10H2O查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| Na、Mg、Al的物质的量x | x<
|
| ③ | ④ | ||||
| 产生H2的体积 | ① | ② | V(Na)>V(Mg)=V(Al) | V(Na)=V(Mg)=V(Al) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4+2O2═CO2+2H2O | ||||
| B、2Na+2H2O=2NaOH+H2↑ | ||||
C、2KClO3
| ||||
| D、CaCO3+2HCl=CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、NaOH溶液与足量的Ca(HCO3)2溶液反应:2HCO3-+2OH-+Ca2+═CaCO3↓+2H2O |
| C、等物质的量的FeBr2和Cl2在溶液中的反应:2Fe2++2Br -+2Cl2═2Fe3++Br2+4Cl- |
| D、重铬酸钾溶液中滴加氢氧化钠溶液后变为黄色:Cr2O72-(橙色)+OHˉ?2CrO42- (黄色)+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com