
A、HCl的电子式: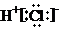 |
| B、C-12原子:12C |
| C、乙酸的结构简式:C2H4O2 |
| D、NH3?H2O的电离方程式:NH3?H2O→NH4++OH- |
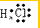 ,故A错误;
,故A错误;

科目:高中化学 来源: 题型:
| A、凡是能发生银镜反应的物质一定是醛或羧酸中的甲酸 |
| B、异丙醇催化氧化后生成丙醛 |
| C、在酯化反应中,醇提供羟基中的氢原子 |
| D、饱和二元醇的组成符合CnH2n+2O2(n≥1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.01×105 Pa、25℃时,2.24 L Cl2中含有的原子数为0.2×6.02×1023 |
| B、0.1L 3mol?L-1 NH4NO3溶液中含有的N原子数目为0.3×6.02×1023 |
| C、5.6g铁粉与足量CuSO4溶液反应生成的铜原子数为1×6.02×1023 |
| D、46g NO2和N2O4的混合物中含有的原子数为3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Na+、SO42-、CO32-? |
| B、Ba2+、OH-、NO3-、Na+ |
| C、K+、Na+、Fe3+、NO3- |
| D、Mg2+、K+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水 |
| B、KMn04溶液 |
| C、Na2S04溶液 |
| D、溴的四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、NO3- |
| B、Cu2+、Na+、Cl- |
| C、Ba2+、K+、CO32- |
| D、CH3COO-、OH-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
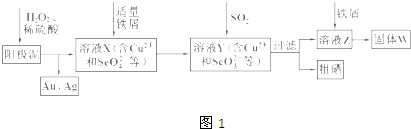

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com