
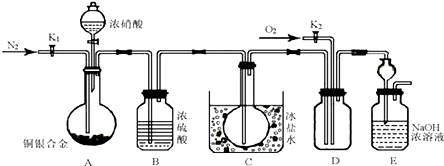
分析 (1)根据铜和浓硝酸反应生成二氧化氮、硝酸铜和水,随着反应的进行,硝酸浓度变稀,铜和稀硝酸反应生成一氧化氮气体,硝酸铜和水;
(2)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮;B装置是利用浓硫酸的吸水性吸收气体中的水蒸气避免在C中 冷却后水和二氧化氮反应生成一氧化氮;
(3)一氧化氮和氧气反应生成红棕色二氧化氮气体;
(4)由于装置中有残留的气体,所以要打开K1、K2持续通入一段时间的N2和O2,以把气体完全排尽;
(5)硝酸的总的物质的量n=13.5mol•L1×0.04L=0.54mol,剩余硝酸n=1mol•L1×0.04L=0.04mol,确定反应的硝酸的物质的量;
(6)铜银合金和硝酸全部反应生成铜盐和银盐,利用A装置中银离子和氯离子形成的沉淀称量计算得到合金中铜的质量分数.
解答 解:(1)铜和浓硝酸反应生成二氧化氮、硝酸铜和水,随着反应的进行,硝酸浓度变稀,铜和稀硝酸反应生成一氧化氮气体,硝酸铜和水,反应的可能化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮;B装置是利用浓硫酸的吸水性吸收气体中的水蒸气避免在C中冷却后水和二氧化氮反应生成一氧化氮,
故答案为:排除系统的空气,防止NO氧化为NO2;吸收水蒸气,防止水蒸气在C中冷凝后与NO2反应产生NO;
(3)A中的反应停止后,打开D中的活塞K2再通入氧气,若反应中确有NO产生,一氧化氮和氧气反应生成红棕色气体二氧化氮气体;
故答案为:无色气体变成红棕色气体;
(4)由于装置中有残留的气体,所以在A中反应完成和D中出现现象后还须进行的操作是:打开K1、K2持续通入一段时间的N2和O2,以把气体完全排尽;
故答案为:打开K1、K2持续通入一段时间的N2和O2;
(5)硝酸的总的物质的量n=13.5mol•L1×0.04L=0.54mol,剩余硝酸n=1mol•L1×0.04L=0.04mol,所以参加反应的硝酸是0.54mol-0.04mol=0.5mol;
故答案为:0.5mol;
(6)铜银合金和硝酸全部反应生成铜盐和银盐,利用A装置中银离子和氯离子形成的氯化银沉淀称量,即在A中加入过量的Cl-的溶液,过滤、洗涤、干燥并称量沉淀的质量,从而计算得到合金中铜的质量分数,
故答案为:在A中加入过量的Cl-的溶液,过滤、洗涤、干燥并称量沉淀的质量.
点评 本题考查了物质性质的实验设计,涉及硝酸性质,实验步骤和产物性质及其反应现象是解题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离方程式:H2CO3?H++CO32- | |
| B. | 少量二氧化硫通入氢氧化钠溶液中的化学方程式:SO2+NaOH═NaHSO3 | |
| C. | 碳酸氢钠溶液显碱性:HCO3-+H2O═H3O++CO32- | |
| D. | 向小苏打溶液中加入过量的石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
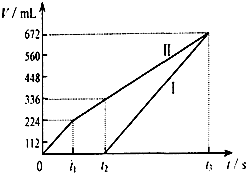 电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.
电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| B. | 新制的0.1mol/L氯水中加入少量的CaCO3固体,HClO的物质的量浓度减小 | |
| C. | Na2O和Na2O2都能与H2O反应,其反应原理不相同 | |
| D. | O3、H2O2、SO2、Na2O2均有漂白性,其原理不尽相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中共转移电子3mol | |
| B. | 反应中共消耗锌97.5 g | |
| C. | 气体A中SO2和H2的体积比为4:1 | |
| D. | 稀释后的溶液中c(SO42-)=1.55 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32g氧气所含的原子数为NA | |
| B. | 标准状况下,22.4L 四氯化碳的分子数为NA | |
| C. | 0℃,101KPa下,44.8L氮气所含有的分子数为2NA | |
| D. | 常温常压下,1mol氦气含有的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
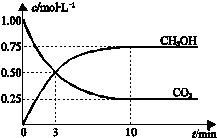 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )| A. | 升高温度能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大 | |
| B. | 反应达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| D. | 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075mol/(L.min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com