
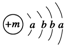 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子. .
.分析 X原子的结构示意图为 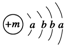 ,由于K最多容纳2个电子,L层最多容纳8个电子,可知a=2,b=8,故X为Ca元素;由化学XY2可知Y的化合价为-1价,而X的阳离子与Y的阴离子的电子层结构相同,离子核外电子数均为18,则Y原子核外电子数为17,故Y为Cl,则该融雪剂为CaCl2;元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,符合条件的元素有He、C、S,由于Z与Y相邻且Z、W能形成一种WZ2型分子,则Z为S元素,W为C元素,二者形成的分子为CS2,据此解答.
,由于K最多容纳2个电子,L层最多容纳8个电子,可知a=2,b=8,故X为Ca元素;由化学XY2可知Y的化合价为-1价,而X的阳离子与Y的阴离子的电子层结构相同,离子核外电子数均为18,则Y原子核外电子数为17,故Y为Cl,则该融雪剂为CaCl2;元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,符合条件的元素有He、C、S,由于Z与Y相邻且Z、W能形成一种WZ2型分子,则Z为S元素,W为C元素,二者形成的分子为CS2,据此解答.
解答 解:X原子的结构示意图为 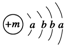 ,由于K最多容纳2个电子,L层最多容纳8个电子,可知a=2,b=8,故X为Ca元素;由化学XY2可知Y的化合价为-1价,而X的阳离子与Y的阴离子的电子层结构相同,离子核外电子数均为18,则Y原子核外电子数为17,故Y为Cl,则该融雪剂为CaCl2;元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,符合条件的元素有He、C、S,由于Z与Y相邻且Z、W能形成一种WZ2型分子,则Z为S元素,W为C元素,二者形成的分子为CS2.
,由于K最多容纳2个电子,L层最多容纳8个电子,可知a=2,b=8,故X为Ca元素;由化学XY2可知Y的化合价为-1价,而X的阳离子与Y的阴离子的电子层结构相同,离子核外电子数均为18,则Y原子核外电子数为17,故Y为Cl,则该融雪剂为CaCl2;元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,符合条件的元素有He、C、S,由于Z与Y相邻且Z、W能形成一种WZ2型分子,则Z为S元素,W为C元素,二者形成的分子为CS2.
(1)由上述分析可知,m=2+8+8+2=20,该融雪剂的化学式为CaCl2,用电子式表示氯化钙的形成过程: ,
,
故答案为:20;CaCl2; ;
;
(2)由上述分析可知,Z为硫元素、W为碳元素,
故答案为:硫;碳;
(3)A.CaCl2属于离子化合物,而CS2是共价化合物,故A错误;
B.CaCl2中仅含离子键,CS2中只含共价键,且是极性共价键,故B正确;
C.因氯的非金属性强于硫,所以稳定性HCl>H2S,故C错误;
D.核外电子排布相同的离子,核电荷数越大,离子的半径越小,所以半径Ca2+<Cl-,故D错误,
故选:B;
(4)A.CaCl2为离子化合物,电子式为: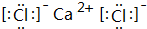 ,故A错误;
,故A错误;
B.CS2是直线形分子,结构式为S=C=S,故B正确;
C.Cl2与H2S水溶液反应的离子方程式为:Cl2+H2S═2H++2Cl-+S↓,故C错误,
故选:B;
(5)冰雪的化学成分是H2O,水的沸点比H2S的沸点高,是由于水分子之间存在氢键,
故答案为:水分子之间存在氢键.
点评 本题考查的知识点较多,涉及核外电子排布、电子式、化学键、元素周期律、微粒半径比较等,难度不大,根据核外电子排布和原子结构推导出元素是解题的关键,注意对基础知识的掌握.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
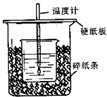 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.已知比热容是4.18J/(g.℃).回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.已知比热容是4.18J/(g.℃).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>Na>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl和AgNO3 | B. | Na2CO3和稀盐酸 | C. | Al2(SO4)3和NaOH | D. | 盐酸和Na[Al(OH)4] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe、FeO和Fe2O3的混合物中加入过量的盐酸 | |
| B. | 等物质的量的 NaHCO3溶液与 Na2O2固体 | |
| C. | 等物质的量浓度、等体积的(NH4)2SO4与 BaC12溶液 | |
| D. | 在NaBr溶液中通入过量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
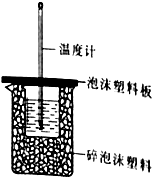 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4,少量X |
| 实验现象 (间) | A大于B(填大于或小于) | |
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com