
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。下列分析不正确的是( )

A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. c点,两溶液中含有相同量的OH–
D. a、d两点对应的溶液均显中性
【答案】C
【解析】A.Ba(OH)2溶液和H2SO4、NaHSO4溶液反应方程式分别为H2SO4+Ba(OH)2=BaSO4↓+2H2O、NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,即①代表滴加H2SO4溶液的变化曲线,A正确;B.根据图知,a点为Ba(OH)2溶液和H2SO4恰好反应,H2SO4、NaHSO4溶液的物质的量浓度相等,则b点溶液溶质为NaOH,溶液中大量存在的离子是Na+和OH-,B正确;C.c点,①中稀硫酸过量,溶质为硫酸,②中硫酸氢钠过量,则溶质为NaOH、Na2SO4,因为硫酸根离子浓度相同,②中钠离子浓度大于①中氢离子浓度,所以溶液中氢氧根离子浓度不同,C错误;D.a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水;d点②中溶质为Na2SO4,水和硫酸钠溶液都呈中性,D正确;答案选C。


科目:高中化学 来源: 题型:
【题目】电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A.0.10mol∕L Ag+
B.0.20mol∕L Cu2+
C.0.20mol∕L Zn2+
D.0.20mol∕LPb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 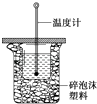
(1)从实验装置上看,图中尚缺少的一种玻璃用品是;
(2)用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值(填“偏 大”、“偏小”或“无影响”);
(3)实验中改用60mL 0.50mol/L 盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 2mL0.5mo/L硅酸钠溶液中滴入适量盐酸制备硅酸胶体,所得胶粒数目为0.001NA
B. 1molNa2O2中含有的离子总数是4NA
C. 常温常压下,7.8gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA
D. 2.7gAl与足量氢氧化钠溶液反应,反应过程中转移的电子数目是0.15NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通人适量KOH溶液中,产物中可能有KCl、KClO、KClO3,且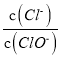 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A. 若某温度下,反应后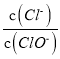 =3,则溶液中
=3,则溶液中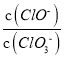 =5:2
=5:2
B. 参加反应的氯气的物质的量等于0.5amol
C. 改变温度,反应中转移电子的物质的量ne-的范围: ![]()
D. 改变温度,产物中KCl的最大理论产量为![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种用CO2生产甲醇燃料的方法.已知:
CO2(g)+3H2(g)CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
CH3OH(g)═CH3OH(l)△H=﹣bkJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣ckJmol﹣1;
则表示CH3OH(l)燃烧热的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径. 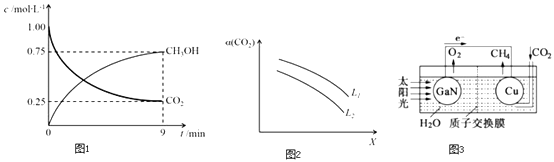
(1)将煤转化成水煤气的反应:C(s)+H2O(g)CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H(填“增大”、“减小”或“不变”),判断的理由是 .
(2)CO2制备甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 在体积为1L的密闭容器中,充入1mol CO2和3mol H2 , 测得CO2(g) 和CH3OH(g) 浓度随时间变化如图1所示.
①该反应化学平衡常数K的表达式是 .
②0~9min时间内,该反应的平均反应速率ν(H2)=
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是(填字母序号)kJ.
0<Q<29.5 b.29.5<Q<36.75 c.36.75<Q<49 d.49<Q<98
④在一定条件下,体系中CO2的平衡转化率(α)与L和 X的关系如图2所示,L和X 分别表示温度或压强.
X表示的物理量是. 判断L1与L2飞大小关系.
(3)科学家用氮化镓材料与铜组装如图3的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4 .
写出铜电极表面的电极反应式,为提高该人工光合系统的工作效率,可向装置中加入少量(选填“盐酸”或“硫酸”).
(4)利用CO2和NH3为原料也合成尿素,在合成塔中的主要反应可表示如下:
反应①:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=
反应②:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H2=+72.49kJmol﹣1
总反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=﹣86.98kJmol﹣1;
则反应①的△H1= .
(5)现将amol铁和bmol铜的混合物与含有cmolHNO3的稀溶液充分反应,设还原产物为NO.下列结论不正确的是(填序号)
A.若剩余金属0.5amol,则氧化产物为一种或二种
B.若只有一种氧化产物,则3c=8a
C.若有二种氧化产物,被还原的硝酸物质的量为0.25cmol
D.若有三种氧化产物,被还原的硝酸物质的量为0.25cmol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题:

(1)A仪器的名称: ________。B中发生反应的离子方程式为_______________________。
(2)为了获得纯净干燥的氯气, C、D中应分别放入的试剂为C_________;D________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是_____________________。
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成__________________。
(5)整套装置存在不妥之处,请画出你认为应该补充的装置,并说明放置的位置_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com