
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
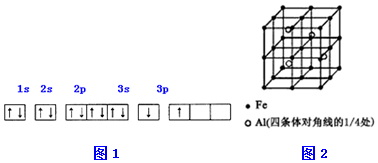
 .
.分析 (1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,3s能级能量比3p能级低,每个轨道最多只能容纳两个电子,且自旋相反配对,2p能级的轨道内有自旋方向相同的2个电子;
由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg,镁价层电子排布为3s2;
②BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型;
(2)①体心立方堆积,如: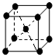 ,属于钾、钠和铁型,其原子的配位数为8;
,属于钾、钠和铁型,其原子的配位数为8;
②等电子体中原子个数相等、价电子数相等,CN-含有2个原子、价电子数是10,与单质氮气分子是等电子体关系;
③六氰合亚铁离子[Fe(CN)6]4-中存在配位键,极性共价键,CN-电子式为 ,则C、N间存在σ键和π键;
,则C、N间存在σ键和π键;
(3)①由晶胞图2,晶胞中含有4个Al原子,且都位于晶胞内部,则晶胞平均含有4个Al,晶胞中Fe位于顶点的有8个,位于面心的有6个,位于棱上的有12个,位于体心的有1个,根据均摊法计算;
②一个晶胞中含有8个Fe原子和4个Al原子,晶胞的质量为$\frac{56×8+27×4}{{N}_{A}}$g,棱长为$\root{3}{\frac{{m}_{晶胞}}{ρ}}$,两个Fe原子之间的距离.
解答 解:(1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,2p能级的轨道内有自旋方向相同的2个电子,所以违背能量最低原理与泡利原理.由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg,镁价层电子排布为3s2,处于周期表中S区,
故答案为:能量最低原理、泡利原理;S;
②BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型,故答案为:SP;直线;
(2)①体心立方堆积,如: ,属于钾、钠和铁型,其原子的配位数为8,
,属于钾、钠和铁型,其原子的配位数为8,
故答案为:8;
②等电子体中原子个数相等、价电子数相等,CN-含有2个原子、价电子数是10,与单质氮气分子是等电子体关系,氮气的电子式为: ,
,
故答案为: ;
;
③六氰合亚铁离子[Fe(CN)6]4-中存在配位键,极性共价键,CN-电子式为 ,则C、N间存在σ键和π键,
,则C、N间存在σ键和π键,
故答案为:B;
(3)①由晶胞图2,晶胞中含有4个Al原子,且都位于晶胞内部,则晶胞平均含有4个Al,晶胞中Fe位于顶点的有8个,位于面心的有6个,位于棱上的有12个,位于体心的有1个,含有Fe原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$+12×$\frac{1}{4}$+1=8,Fe与 Al原子数目之比为8:4=2:1,故该合金的化学式为Fe2Al,
故答案为:Fe2Al;
②一个晶胞中含有8个Fe原子和4个Al原子,晶胞的质量为$\frac{56×8+27×4}{{N}_{A}}$g,棱长为$\root{3}{\frac{\frac{56×8+27×4}{{N}_{A}}}{ρ}}$,两个Fe原子之间的距离为棱长的一半,即$\root{3}{\frac{139}{2ρ{N}_{A}}}$,
故答案为:$\root{3}{\frac{139}{2ρ{N}_{A}}}$.
点评 本题考查了物质结构和性质,题目比较综合,侧重对物质结构主干知识的考查,涉及杂化理论、化学键、分子结构与性质、晶胞计算等,需要学生具备知识的基础,难度中等,注意对晶胞计算中的常用的均摊法的理解.


科目:高中化学 来源: 题型:选择题
| A. | O2仍然为 1mol | B. | 反应足够长时间后,速率变为零 | ||
| C. | SO2、O2和 SO3 同时存在 | D. | SO2完全转化为 SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下c(H+)为0.01 mol/L的盐酸由H2O电离出的c(H+)=1.0×10-2mol•L-1 | |
| B. | 室温下,对于0.10 mol•L-1的氨水,加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| C. | 有关反应:(tBuNO)2??2(tBuNO),压强越大,反应物的转化率越大 | |
| D. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ③④⑧ | C. | ⑤⑦ | D. | ②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它与水反应的离子方程式为NH4++H-+H2O=NH3•H2O+H2↑ | |
| B. | NH5中既有共价键又有离子键 | |
| C. | NH5的电子式为 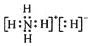 | |
| D. | 1 mol NH5中含有5 NA个N-H键(NA表示阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的沸点:H2O>PH3>NH3 | |
| B. | 第三周期元素(除惰性元素),随着原子序数的递增,元素的最高化合价逐渐升高 | |
| C. | 同主族元素从上到下,非金属性逐渐增强,金属性逐减弱 | |
| D. | P的非金属性强于Si,H2SiO3的酸性强于H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 醋酸 | 碳酸 | 氨水 | 氯水 |
| B | 纯碱 | 碘酒 | 苛性钾 | 醋酸 | 干冰 |
| C | 石油 | 石灰石 | 硫酸 | 磷酸 | 水 |
| D | 烧碱 | 天然气 | 氯化钠 | 碳酸钠 | 蔗糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.6mol | |
| B. | 50mL 2mol•L-1的NaCl溶液和100 mL L 0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol•L-1 | |
| D. | 10g 98%的硫酸(密度为1.84g•cm-3)与10mL 18.4mol•L-1的硫酸的浓度是相同的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com