


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
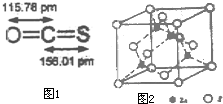 用于合成氨的工业煤气中含有S2H、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理.
用于合成氨的工业煤气中含有S2H、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理.查看答案和解析>>
科目:高中化学 来源: 题型:
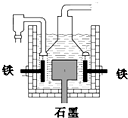 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为4NaOH(熔融)═4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法不正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为4NaOH(熔融)═4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法不正确的是( )| A、电解熔融氢氧化钠制钠,阴极发生电极反应为:Na++e-═Na | B、盖?吕萨克法制钠原理是熵的增加带动了反应的进行 | C、若戴维法与盖?吕萨克法制得等量的钠,则两反应中转移的电子总数比为1:1 | D、目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com