
 反应类型加聚反应
反应类型加聚反应 反应类型取代反应
反应类型取代反应 反应类型取代反应
反应类型取代反应分析 (1)丙烯分子含有碳碳双键,发生加聚反应生成聚丙烯;
(2)甲苯与浓硝酸发生取代反应可生成TNT,即三硝基甲苯;
(3)苯与液溴发生取代反应生成溴苯;
(4)乙烯含碳碳双键,与溴水发生加成反应.
解答 解:(1)丙烯能发生加聚反应得到聚丙烯,方程式为 ,属于加聚反应,
,属于加聚反应,
故答案为: ;加聚反应;
;加聚反应;
(2)甲苯可以和浓硝酸之间发生取代反应生成2,4,6-三硝基甲苯,即TNT,化学反应方程式为 ,属于取代反应;
,属于取代反应;
故答案为: ;取代反应;
;取代反应;
(3)苯与液溴反应苯环上的氢原子被溴原子代替生成溴苯和溴化氢,化学方程式为: ,属于取代反应;
,属于取代反应;
故答案为: ;取代反应;
;取代反应;
(4)乙烯含碳碳双键,与溴水发生加成反应,反应为CH2=CH2+Br2→BrCH2CH2Br,故答案为:CH2=CH2+Br2→BrCH2CH2Br;加成反应.
点评 本题考查有机反应化学方程式的书写,为高频考点,把握有机物的性质、反应及反应类型为解答的关键,侧重分析与应用能力的考查,注意有机反应类型的判断,题目难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 从海带中提取单质碘及碘的化合物间的转化关系如图所示:
从海带中提取单质碘及碘的化合物间的转化关系如图所示:
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
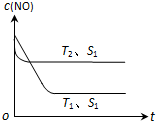 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从环境保护角度,氟氯代烷不宜用作制冷剂 | |
| B. | 聚氯乙烯制品适宜用于直接盛装食物 | |
| C. | 苯、甲苯、二甲苯都是基本的有机化工原料 | |
| D. | 乙烯用作果实催熟剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
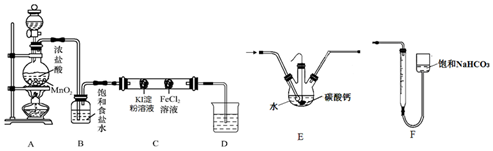
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
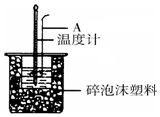 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com