
����Ŀ������NO2��SO2��CO���к�����Դ���������Σ����������Ĺ�ͬ��
��1����ԭ�Ӿ���ѧԭ�������£���ѧ����CO��H2�ڼ��ȼ�ѹ�����ϳ���Һ��ȼ�ϼ״����仯ѧ��Ӧ����ʽΪ__��
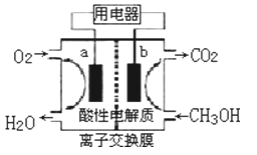
��2���Լ״���ȼ�ϵĵ�أ���ͼ��ʾ���为����__����a��b���������ķ�ӦʽΪ___�������ķ�ӦʽΪ___����ȼ�ϵ��������״̬�£�����96.5%�Ļ�ѧ��ת���ɵ��ܣ�������1molҺ��״����ܲ����������ܴ�702.1kJ����ͨ���״�ȼ�յ��Ȼ�ѧ��Ӧ����ʽΪ__��
��3����֪��NO2��g��+SO2��g��SO3��g��+NO��g�� ��H=+41.8kJmol��1��һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����___��
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����1molSO3��ͬʱ����1molNO2
��������Ӧƽ��ʱ�����NO2��SO2�����Ϊ1��6����ƽ�ⳣ��K=__�������Ѵ�ƽ��״̬��������Ӧ����ʱ��ƽ�ⳣ��K��__�������С�䣩
���𰸡�CO+2H2![]() CH3OH b CH3OH��6e-+H2O=CO2+6H+ O2+4H++4e-=2H2O CH3OH��l��+
CH3OH b CH3OH��6e-+H2O=CO2+6H+ O2+4H++4e-=2H2O CH3OH��l��+![]() O2��g��=CO2��g��+2H2O��l�� ��H=��727.6kJ/mol b
O2��g��=CO2��g��+2H2O��l�� ��H=��727.6kJ/mol b ![]() ���
���
��������
��1������CO��H2�ڼ��ȼ�ѹ�����ϳɼ״�д����Ӧ����ʽ��
��2��ȼ�ϵ����ͨ��ȼ�ϵ�һ��Ϊ������������ȼ��ʧ���ӷ���������Ӧ���������������õ��ӷ�����ԭ��Ӧ����ȼ�ϵ�صĵ������Һ�����ԣ����Ը����ϼ״�ʧ���Ӻ�ˮ��Ӧ���ɶ�����̼�������ӣ�����������������ˮ��96.5%�Ļ�ѧ��ת���ɵ��ܣ�������1molҺ��״����ܲ����������ܴ�702.1kJ��ȼ��1molҺ��״��ų�����Ϊ��![]() ��Ȼ��д�����Ȼ�ѧ����ʽ��
��Ȼ��д�����Ȼ�ѧ����ʽ��
��3���ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ɴ�������һЩ������Ҳ���䣬����ƽ��ʱ�����ʵ�Ũ�ȣ��ɼ���ƽ�ⳣ������H��0�������¶�ƽ�����ƣ�K���
(1)����CO��H2�ڼ��ȼ�ѹ�����ϳɼ״�д������Ϊ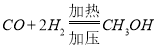
���ʴ�Ϊ��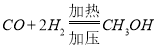 ��
��
(2)ȼ�ϵ����ͨ��ȼ�ϵ�һ��Ϊ������������ȼ��ʧ���ӷ���������Ӧ���������������õ��ӷ�����ԭ��Ӧ����ȼ�ϵ�صĵ������Һ�����ԣ����Ը����ϼ״�ʧ���Ӻ�ˮ��Ӧ���ɶ�����̼�������ӣ���˸���Ϊb��������ӦʽΪCH3OH-6e-+H2O=CO2+6H+������������������ˮ�������缫��ӦʽΪ��O2+4e-+4H+�T2H2O��96.5%�Ļ�ѧ��ת���ɵ��ܣ�������1molҺ��״����ܲ����������ܴ�702.1kJ��ȼ��1molҺ��״��ų�����Ϊ![]() �����Ȼ�ѧ����ʽΪ��CH3OH��l��+
�����Ȼ�ѧ����ʽΪ��CH3OH��l��+![]() O2��g��=CO2��g��+2H2O��l����H=��727.6kJ/mol���ʴ�Ϊ��b��CH3OH-6e-+H2O=CO2+6H+��CH3OH��l��+
O2��g��=CO2��g��+2H2O��l����H=��727.6kJ/mol���ʴ�Ϊ��b��CH3OH-6e-+H2O=CO2+6H+��CH3OH��l��+![]() O2��g��=CO2��g��+2H2O��l����H=��727.6kJ/mol��
O2��g��=CO2��g��+2H2O��l����H=��727.6kJ/mol��
(3)a�������Ƿ�ﵽƽ�⣬��ϵѹǿ�����ֲ��䣬���������ж��Ƿ�ﵽƽ��״̬����a����
b�����������ɫ���ֲ��䣬˵��Ũ�Ȳ��䣬�ﵽƽ��״̬����b��ȷ��
c��SO3��NO�ļ�����֮��Ϊ1��1�������Ƿ�ﵽƽ�⣬���ߵ�����ȱ��ֲ��䣬�����ж��Ƿ�ﵽƽ��״̬����c����
d�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���ÿ����1mol SO3��ͬʱ����1molNO2�������ж��Ƿ�ﵽƽ��״̬����d����
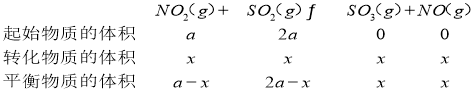 ��ƽ��ʱNO2��SO2�����Ϊ1��6������a-x������2a-x��=1��6����
��ƽ��ʱNO2��SO2�����Ϊ1��6������a-x������2a-x��=1��6����![]() ����ƽ�ⳣ��
����ƽ�ⳣ��![]() ����֪��H��0�������¶�ƽ�����ƣ�K��ʴ�Ϊ��b��
����֪��H��0�������¶�ƽ�����ƣ�K��ʴ�Ϊ��b��![]() �����
�����


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ü����Ӧ����ʱ�����ܴﵽĿ����

��X������װ�á�Y������װ�ã�
ʵ��Ŀ�� | �Լ�X | �Լ�Y | |
A | �����������л��е�NO2 | CCl4�Լ� | ʯ����Һ |
B | ����HI�л��е�HCl | ����NaCl��Һ | AgNO3��Һ |
C C | Ũ������MnO2������ȡ������ | NaOH��Һ | ����KI��Һ |
D | C2H5OH��ŨH2SO4������170����ȡ����ϩ | NaOH��Һ | Br2��CCl4��Һ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��
��![]() ��
��![]() �ڹ�ҵ����������Ҫ��Ӧ�á�
�ڹ�ҵ����������Ҫ��Ӧ�á�
��1����![]() ���������е�
���������е�![]() ������
������![]() ��
��![]() ���ֵ��ʡ��ڸ÷�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ_________________________��
���ֵ��ʡ��ڸ÷�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ_________________________��
��2������![]() ������
������![]() ��Ⱦ���䷴ӦΪ
��Ⱦ���䷴ӦΪ![]() ����ͬ�¶��£���װ������
����ͬ�¶��£���װ������![]() �����
�����![]() �����ܱ�������ͨ��
�����ܱ�������ͨ��![]() �����
�����![]() ������������
������������![]() ��ʱ��
��ʱ��![]() �ı仯������ͼ��ʾ��
�ı仯������ͼ��ʾ��

���¶�ΪT2ʱ��![]() �ڣ�
�ڣ�![]() ��ƽ����Ӧ����
��ƽ����Ӧ����![]() _____________________��
_____________________��
�ڸ÷�Ӧ��![]() ________0������>����<������=�������жϵ�������_________________��
________0������>����<������=�������жϵ�������_________________��
��3�������£���֪![]() �ĵ���ƽ�ⳣ��
�ĵ���ƽ�ⳣ��![]() ��
��![]() ��ͨ������ɵ�
��ͨ������ɵ�![]() ��
��![]() ��Һ
��Һ![]() ___________��
___________��
��4��Ϊ��ȷ��![]() �������ʷ���ʽ
�������ʷ���ʽ![]() ��
��![]() ��ֵ��ȡ����������������Ӧʵ�顣���ܽ�
��ֵ��ȡ����������������Ӧʵ�顣���ܽ�![]() ��Ũ��Ϊ
��Ũ��Ϊ![]() ʱ��
ʱ��![]() �����ʣ�
�����ʣ�![]() ����ֵ�Ĺ�ϵ���±���ʾ����
����ֵ�Ĺ�ϵ���±���ʾ����![]() _______��
_______��
| 3.65 | 7.30 | 10.95 | 14.60 |
| 10.2 | 40.80 | 91.80 | 163.20 |
��5��ij��ҵ��ˮ�к���![]() ��
��![]() �����ӡ�ȡһ�����ĸù�ҵ��ˮ�������еμ�
�����ӡ�ȡһ�����ĸù�ҵ��ˮ�������еμ�![]() ��Һ����
��Һ����![]() ��ʼ����ʱ����Һ��
��ʼ����ʱ����Һ�� _______��������λ��Ч���֣�������֪��25��ʱ��
_______��������λ��Ч���֣�������֪��25��ʱ��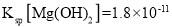 ��
��![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦmA(s��+nB(g��![]() pC(g�� ��H��0,��һ���¶��£�ƽ��ʱB�����������B%����ѹǿ�仯�Ĺ�ϵ��ͼ��ʾ������������һ����ȷ����
pC(g�� ��H��0,��һ���¶��£�ƽ��ʱB�����������B%����ѹǿ�仯�Ĺ�ϵ��ͼ��ʾ������������һ����ȷ����

��m+n>p ��y���ʾ������Ӧ����С���淴Ӧ����
��n>p ��x���y��ʱ�ķ�Ӧ������
���������¶ȣ��÷�Ӧ��ƽ�ⳣ������
A.�٢ڢ�B.�ڢܢ�
C.ֻ�Т٢�D.�٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ�����Դ���Ź㷺��Ӧ��ǰ����������Ȼ���Ʊ�������������ͼ��
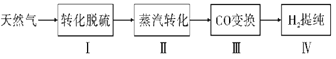
��ش��������⣺
I.ת��������Ȼ��ѹ����������30��ʱ����T��F�������£����Ի������������ʾ��ͼ���¡�

��1������i�����ӷ�Ӧ����ʽΪ__��
��2����֪��
��Fe3+��pH=1.9ʱ��ʼ����pH=3.2ʱ������ȫ��
��30��ʱ����T��F�������£���ͬpH��FeSO4��Һ��Fe2+���������������
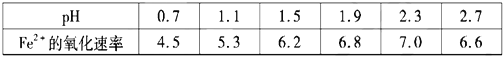
����˵����ȷ����___
A����ת�������У���ѵ�pH��Χ��1.5<pH<1.9
B����ת����������Ҫ���ϲ���Fe2(SO4)3
C����ת����������O2��ӵذ�H2S����ΪS
D����ת��������CH4��Ϊ��ԭ��������
��.����ת�����ڴ����������£�ˮ������CH4�����������ͼ�ش����⡣

��3���ٸù��̵��Ȼ�ѧ����ʽ��__��
�ڱȽ�ѹǿp1��p2�Ĵ�С��ϵ��p1__p2(ѡ����<������>������=��)��
��.CO�任��500��ʱ��CO��һ����ˮ��Ӧ����CO2��H2��
��.�ᴿ����CO2��H2����õ�H2�Ĺ���ʾ��ͼ��ͼ��
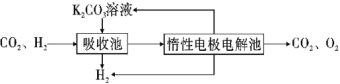
��4�����ճ��з�����Ӧ�����ӷ���ʽ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ����гɹ����漰�����У���Ҫ�ɷ�Ϊͬ����Ԫ���γɵ����ǽ������ϵ���
|
|
|
|
A��4.03�״�ھ�̼���跴�侵 | B��2022�궬�»�۰����ٻ��� | C�������ε�Ų���̼������������ | D�������ö������ѺϽ�ɸ���� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȼ�շ��ⶨij�ְ�����(CxHyOzNm)�ķ�����ɡ�ȡWg���ְ�������ڴ����г��ȼ�գ����ɶ�����̼��ˮ�͵���������ͼ��ʾװ�ý���ʵ�顣
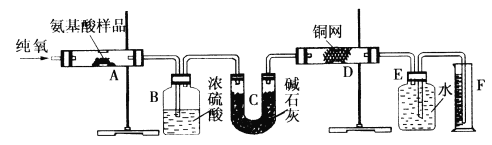
�ش��������⣺
��1��ʵ�鿪ʼʱ������ͨ��һ��ʱ�����������������__________________��
��2������װ������Ҫ���ȵ�������_______ (��д��ĸ)������ʱӦ�ȵ�ȼ_____���ľƾ��ơ�
��3��Aװ���з�����Ӧ�Ļ�ѧ����ʽ��____________________________��
��4��Dװ�õ�������____________________________��
��5����ȡ���������ʱ��Ӧע����_________________����_________________��
��6��ʵ���в�õ��������ΪVmL(��״��)��Ϊȷ���˰�����ķ���ʽ������Ҫ���й�������____________________��
A�����ɶ�����̼���������
B������ˮ������
C��ͨ�����������
D�����������Է�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѧ�һ����һ���ȶ��Ժá�����������ǿ�Ļ��Ի�����A����ṹ���£�
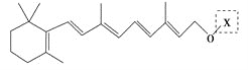
Ϊ���о�X�Ľṹ����������A��һ��������ˮ��ֻ�õ�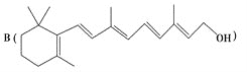 ��C����Ԫ�ط�������Է��������ⶨ��ȷ��C�ķ���ʽΪC7H6O3��C��FeCl3ˮ��Һ����ɫ����NaHCO3��Һ��Ӧ��CO2������
��C����Ԫ�ط�������Է��������ⶨ��ȷ��C�ķ���ʽΪC7H6O3��C��FeCl3ˮ��Һ����ɫ����NaHCO3��Һ��Ӧ��CO2������
��ش��������⣺
(1)������B�ܷ���������Щ���͵ķ�Ӧ________��
A��ȡ����Ӧ B���ӳɷ�Ӧ
C�����۷�Ӧ D��������Ӧ
(2)д��������C���п��ܵĽṹ��ʽ______________________________��
(3)C��ͨ����ͼ��ʾ;���ϳɣ�����ȡ�����ͺͰ�˾ƥ�֡�
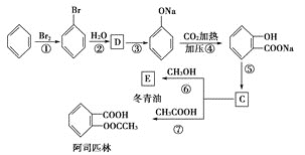
(��)д���л���Ľṹ��ʽ��D��______________��C��________________��E��______________��
(��)д���仯�������������Ļ�ѧ����ʽ(ע����Ӧ����)
��Ӧ��__________________________________����Ӧ��_____________________________��
(��)�仯�����е�������____________��Ӧ��������________��Ӧ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com