
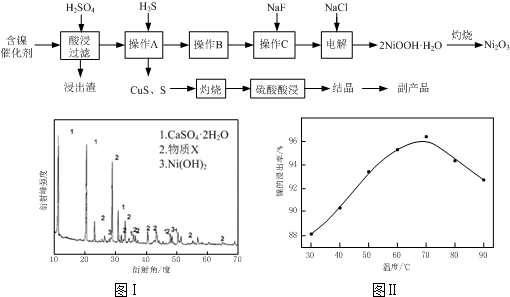
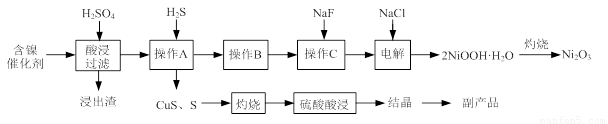
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
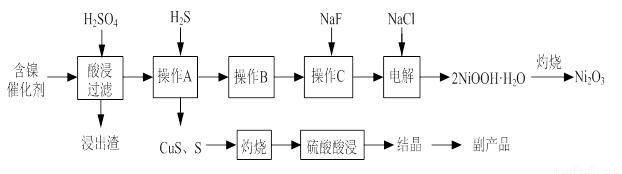
图Ⅰ 图Ⅱ
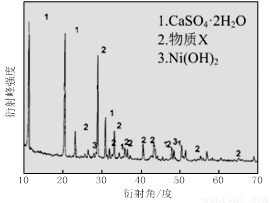
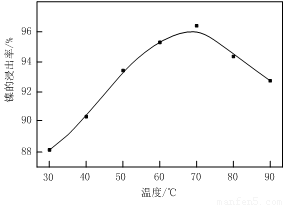
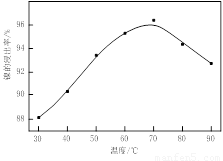
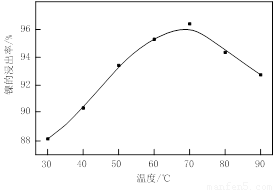
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
|
氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
开始沉淀的pH |
1.5 |
6.5 |
7.7 |
|
沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 ______mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
(1)BaSO4 温度升高,Ni2+的水解程度增大
(2)CuSO4·5H2O
(3)方案错误。在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(其他合理均给分)
(4)3×10-6
(5)ClO-+2Ni2++4OH-=2NiOOH·H2O+Cl-
【解析】
试题分析:(1)由于含镍催化剂中含有氧化钡,能和稀硫酸反应生成白色沉淀硫酸钡,所以根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为BaSO4。由于随着温度升高,Ni2+的水解程度增大,从而导致镍的浸出率降低,浸出渣中Ni(OH)2含量增大。(2)CuS、S灼烧后溶于稀硫酸中生成硫酸铜,所以副产品应该是胆矾,即CuSO4·5H2O。(3)用氢氧化钠溶液调节溶液的pH值,容易引入杂质,所以方案是错误的。正确的操作应该是在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+。(4)根据常温时CaF2的溶度积常数为2.7×10-11可知,溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为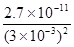 =3×10-6 mol/L。(5)Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,其还原产物是氯离子,则根据电子的得失守恒可知,第②步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH·H2O+Cl-。
=3×10-6 mol/L。(5)Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,其还原产物是氯离子,则根据电子的得失守恒可知,第②步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH·H2O+Cl-。
考点:考查盐类水解、化学实验基本操作、溶度积常数的计算、方程式的书写


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:阅读理解
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市高三第三次模拟化学试卷(解析版) 题型:填空题
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
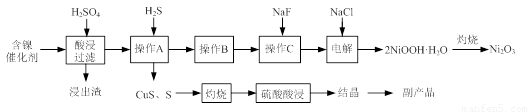
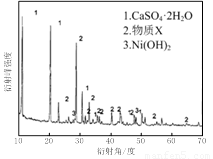
图Ⅰ 图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
|
氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
开始沉淀的pH |
1.5 |
6.5 |
7.7 |
|
沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通、泰州、扬州连云港淮安高三第三次调研5月测试化学卷(解析版) 题型:填空题
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:

图Ⅰ 图Ⅱ
⑴根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
⑵工艺流程中“副产品”的化学式为 。
⑶已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
|
氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
开始沉淀的pH |
1.5 |
6.5 |
7.7 |
|
沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
⑷操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
⑸电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com