
【题目】常见的电子气体有BCl3、N2O、SiH4及SiHCl3等。回答下列问题:
(1)气体B2H6与氯气混合可生成气态BCl3,每生成1.0 g BCl3放出5.9 kJ的热量,该反应的热化学方程式为______。
(2)25℃时反应 S(s) +H2(g)H2S(g) Kp1=6.0×105
Si(s)+2H2(g)SiH4(g) Kp2=7.8×106
则反应 Si(s)+2H2S(g)SiH4(g)+2S(s) Kp=_____(Kp为以分压表示的平衡常数,下同)。
(3)多晶硅制中发生一系列反应:
(I)4SiHCl3(g)Si(s)+3SiCl4(g)+2H2(g) △H1=a kJ /mol
(II)SiCl4(g)+H2(g)SiHCl3(g)+HCl(g) △H2=b kJ/mo1
(III)SiCl2(g)+H2(g)Si(s)+2HCl(g) △H3=c kJ/mo1
①反应SiHCl3 (g)SiCl2 (g) +HCl (g) △H=____kJ/mo1 (用含a、b、c的代数式表示)
②反应(I)(II)(III)的Kp与温度的关系如下图
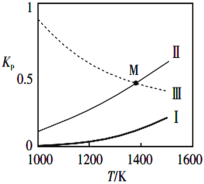
属于吸热反应的是_________(填I、II或III);图中M点分压间满足关系:p(SiCl4)=______(用相关物质的分压p表示)。
(4)一种制取N2O的方法为 O2NNH2(aq)→N2O(g)+H2O(1),该反应的历程如下:
(I)O2NNH2(aq)![]() O2NNH-(aq) +H+(aq) (快速平衡)
O2NNH-(aq) +H+(aq) (快速平衡)
(II)O2NNH-(aq)![]() N2O(g) +OH-(aq) (慢)
N2O(g) +OH-(aq) (慢)
(III)H+(aq)+OH-(aq)![]() H2O(1) (快)
H2O(1) (快)
①活化能最大的反应步骤是_________(填I、II或III)。
②已知反应(I)的速率方程v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),(k1、k -1分别为正逆反应速率常数,反应(I)达到平衡时,平衡常数K=__________(用k1、k -1表示)。
③已知总反应速率方程为v=K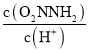 ,反应(II)的v(正)=k2c(O2NNH-),则K=________ (用k1、k -1、k2、k3表示)
,反应(II)的v(正)=k2c(O2NNH-),则K=________ (用k1、k -1、k2、k3表示)
【答案】B2H6(g)+6Cl2(g)=2BCl3(g)+6HCl(g) △H=-1386.5 kJmol-1 2.1710-5 a+3b-c I和II ![]() II
II ![]()
![]()
【解析】
(1)根据质量守恒定律,利用热化学方程式表示的意义,书写该反应的热化学方程式;
(2)将已知的热化学方程式叠加可得待求反应的热化学方程式,根据平衡常数的含义可得叠加反应的化学平衡常数;
(3)①根据盖斯定律将已知热化学方程式叠加,可得待求反应的热化学方程式;
②根据化学平衡常数与温度关系判断反应的热效应;M点是反应II、III的交点,两个反应的化学平衡常数相等,整理可得其数值;
(4)①反应的活化能越大,反应越难进行,反应速率越慢;
②根据反应达到平衡时,正、逆反应速率相等计算该反应的化学平衡常数;
③将反应(I)的速率方程v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),及总反应速率方程为v=K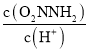 进行整理,可得K的表达式。
进行整理,可得K的表达式。
(1)B2H6与Cl2发生取代反应产生BCl3和HCl,每反应产生1.0 g BCl3放出5.9 kJ的热量,则反应产生2 mol BCl3放出热量Q=2 mol×111.5 g/mol×5.9 kJ/mol=1386.5 kJ,所以气体B2H6与氯气混合生成气态BCl3的热化学方程式为:B2H6(g)+6Cl2(g)=2BCl3(g)+6HCl(g) △H=-1386.5 kJmol-1;
(3)①S(s) +H2(g)H2S(g)Kp1=![]() =6.0×105,
=6.0×105,
②Si(s)+2H2(g)SiH4(g)Kp2=![]() =7.8×106,
=7.8×106,
根据盖斯定律,将②-①×2,整理可得反应Si(s)+2H2S(g)SiH4(g)+2S(s),K= =2.1710-5;
=2.1710-5;
(3)①(I)4SiHCl3(g)Si(s)+3SiCl4(g)+2H2(g)△H1=a kJ /mol
(II)SiCl4(g)+H2(g)SiHCl3(g)+HCl(g)△H2=b kJ/mo1
(III)SiCl2(g)+H2(g)Si(s)+2HCl(g)△H3=c kJ/mo1
(I)+3×(II)- (III),整理可得:SiHCl3 (g)SiCl2 (g) +HCl (g) △H=(a+3b-c) kJ/mol;
②根据图象可知:温度升高,I、II的平衡常数增大,说明升高温度,反应I、II的化学平衡正向移动,而升高温度,反应III的化学平衡常数减小,说明升高温度反应III的化学平衡逆向移动。根据平衡移动原理:升高温度化学平衡向吸热反应方向移动,所以反应I、II的正反应为吸热反应,而反应III的正反应为放热反应;对于SiCl4(g)+H2(g)SiHCl3(g)+HCl(g)化学平衡常数Kp(II)=![]() ;对于反应III,化学平衡常数Kp(III)=
;对于反应III,化学平衡常数Kp(III)=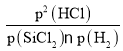 ,由于M点是两个反应交点,此时Kp(II)=Kp(III),所以
,由于M点是两个反应交点,此时Kp(II)=Kp(III),所以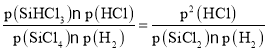
![]()
(4)①由于反应的活化能越大,反应需消耗能量就越多,反应越难进行,化学反应速率就越慢。根据已知条件可知反应(II)化学反应速率最慢,所以活化能最大的反应步骤是II;
②对于反应(I)O2NNH2(aq)![]() O2NNH-(aq) +H+(aq),化学平衡常数K=
O2NNH-(aq) +H+(aq),化学平衡常数K=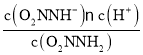 ,由于v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),当反应达到平衡时,v(正)=v(逆),所以k1c(O2NNH2)=k -1 c(O2NNH-)c(H+),则K=
,由于v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),当反应达到平衡时,v(正)=v(逆),所以k1c(O2NNH2)=k -1 c(O2NNH-)c(H+),则K=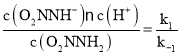 ;
;
③总反应速率方程为v=K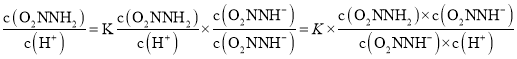 ,由于反应(I)v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),反应(II)v(正)=k2c(O2NNH-),所以
,由于反应(I)v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)c(H+),反应(II)v(正)=k2c(O2NNH-),所以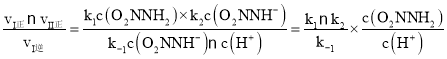 =K
=K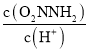 ,故K=
,故K=![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示是由4个碳原子结合成的4种有机物(氢原子没有画出)
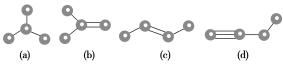
(1)写出有机物(a)的系统命名法的名称________________________。
(2)有机物(a)有一种同分异构体,试写出该同分异构体的结构简式________。
(3)上述有机物中与(c)互为同分异构体的是______(填代号)。
(4)任写一种与(d)互为同系物的有机物的结构简式________。
(5)(a)、(b)、(c)、(d)四种物质中,4个碳原子一定处于同一平面的有________(填代号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕固体,H的焰色呈黄色。
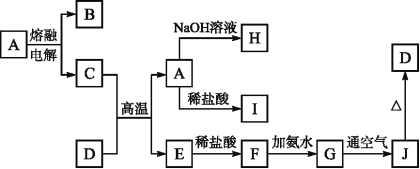
请回答下列问题:
(1)A物质的化学式为________,H物质的名称为______________________。
(2)G![]() J的实验现象是_________________;化学方程式为___________________。
J的实验现象是_________________;化学方程式为___________________。
(3)D与C高温下反应的化学方程式为:________________。
(4)D物质与盐酸恰好反应的离子方程式为__________,所得溶液的颜色为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。
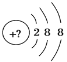
(1)该微粒是中性微粒,这种微粒的符号是________。
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是________。
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒的符号是________。
(4)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性重铬酸盐溶液中加入乙醚和H2O2发生反应![]() +4H2O2+2H+=2CrO(O2)2+5H2O。上层出现蓝色,一段时间后上层蓝色逐渐褪去且水相变为绿色(Cr3+)。下列说法错误的是( )
+4H2O2+2H+=2CrO(O2)2+5H2O。上层出现蓝色,一段时间后上层蓝色逐渐褪去且水相变为绿色(Cr3+)。下列说法错误的是( )
A.溶液出现蓝色的反应属于非氧化还原反应
B.乙醚可用乙醇代替
C.该方法既可用于检验H2O2,又可用于检验![]()
D.水层逐渐变为绿色发生的离子反应为4CrO(O2)2+ 12H+=4Cr3++ 6H2O+7O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹是一种古老的抗疟疾和治疗阿米巴病药物种和物,也是一种治疗自身免疫性疾病的药物。2020年2月19日在《新型冠状病毒肺炎诊疗方案(试行第六版)》里面提出新增口服磷酸氯喳作为抗新冠病毒感染治疗用药。其中间体H的一种合成路线如下:
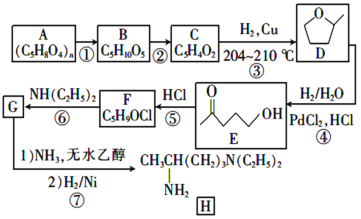
已知:A为半纤维素的一种,属于多糖,B为戊糖, B、C中均含有醛基;C中含有五元环状结构且含一种与D相同的官能团;C中不含碳碳三键。
(1)D中所含官能团的名称是______。
(2)①的反应试剂和条件是________。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,写出B的结构简式,用星号 (*)标出B中的手性碳原子______。
(4)C的结构简式为_______。
(5)⑤的反应类型是________,⑥的化学方程式为________。
(6)化合物W是E的同分异构体,W能发生水解反应,符合题意的W有_____种(不含立体结构),核磁共振氢谱只有两组峰的结构简式是________。
(7)设计以![]() (环氧丙烷)为原料制备
(环氧丙烷)为原料制备![]() 的合成路线(无机试剂任用)______。
的合成路线(无机试剂任用)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子。
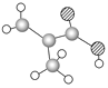
该物质的结构简式为__,该物质中所含官能团的名称为__。
(2)下列各组物质:①O2和O3②H2、D2、T2③12C和14C④CH3CH2CH2CH3和(CH3)2CH2CH3⑤乙烷和丁烷⑥CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)C2H5互为同系物的是__,互为同分异构体的是__,互为同位素的是__,互为同素异形体的是__,是同一物质的是__。
(3)酚酞是常用的酸碱指示剂,其结构简式如图所示:

①酚酞的分子式为__。
②从结构上分析酚酞可看作__。
A.烯烃 B.芳香化合物 C.醇类物质 D.酚类物质 E.醚类物质 F.酯类物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修-物质结构与性质】
已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大,B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同.请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是______(填元素符号)
(2)化合物BD3的分子空间构型可描述为______,B的原子轨道杂化类型为______。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输.已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物.则F的基态原子价电子排布式为______。CN-与______(一种分子)互为等电子体,则1个CN-中π键数目为______。
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为______,
在该晶体中,E4+的氧配为数为______。若该晶胞边长为anm可计算该晶体的密度为______g/cm3(阿伏加德罗常数为NA)
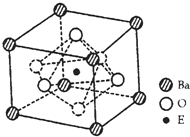
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物在工农业生产中有重要的作用。
(1)P元素有白磷、红磷、黑磷三种常见的单质。
①现代化学中,常利用_______上的特征谱线来鉴定元素。
②白磷(P4)易溶于CS2,难溶于水,原因是_________。
③黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体具有与石墨相类似的层状结构,如下图所示。下列有关黑磷晶体的说法不正确的是_______。
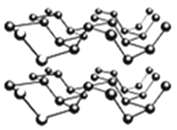
A.黑磷晶体中磷原子杂化方式为sp3杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(2)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化磷和三溴化硼于高温下在氢气中反应合成。磷化硼晶体的晶胞如下图所示,其中实心球为磷原子。

请回答下列问题:
①磷化硼的化学式为_________,该晶体的晶体类型是___________。
②三溴化磷中溴元素基态原子的电子排布式为_________,三溴化硼分子的空间构型是________,合成磷化硼的化学方程式为:___________。
③在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为________,该结构中有一个配位键,提供空轨道的原子是_______。已知晶体中B与P原子的最近距离为a nm,则该晶体的密度的表达式为(不需化简)________g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com