
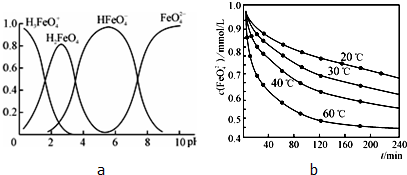
 聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.
聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
| A、称量前先调节托盘天平的零点 |
| B、潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 |
| C、用托盘天平只能称量至0.1g |
| D、称量时左盘放被称量物,右盘放砝码 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 molH2的质量是1 g |
| B、1 mol HCl的质量是36.5 g?mol-1 |
| C、Cl2的摩尔质量等于它的相对分子质量 |
| D、硫酸根离子的摩尔质量是96 g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 表示碳原子,用
表示碳原子,用 表示氧原子,用
表示氧原子,用 表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题: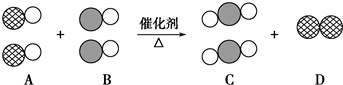
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体 | B、悬浊液 |
| C、溶液 | D、乳浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用广泛pH试纸测得氯水的pH为2 |
| B、用托盘天平称取10.50g干燥的NaCl固体 |
| C、配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液的浓度偏高 |
| D、制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液时,胶头滴管不能伸入液面以下 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
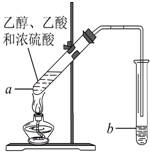 在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com