
| A. | 为了使豆腐白嫩和富有弹性,制作时可使用吊白块(具有漂白性)和烧碱 | |
| B. | 金属Mg失火时不能用泡沫灭火器扑灭 | |
| C. | 土壤胶粒带负电荷,有利于铵态氮肥的吸收 | |
| D. | 水玻璃可用于生产黏合剂和防火剂 |
分析 A.吊白块是一种强致癌物质,烧碱有强烈刺激和腐蚀性;
B.Mg能与二氧化碳反应;
C.土壤胶体带负电荷,可吸收阳离子;
D.水玻璃为硅酸钠的水溶液,具有粘合性,不燃烧、不支持燃烧.
解答 解:A.吊白块是一种强致癌物质,烧碱有强烈刺激和腐蚀性,所以吊白块和烧碱不能用于食品加工,故A错误;
B.泡沫灭火器用二氧化碳灭火,Mg能与二氧化碳反应,所以金属Mg失火时不能用泡沫灭火器扑灭,故B正确;
C.土壤胶体带负电荷,铵根离子带正电荷,可吸收阳离子,有利于吸收,故C正确;
D.水玻璃为硅酸钠的水溶液,具有粘合性,不燃烧、不支持燃烧,则水玻璃可用于生产黏合剂和防火剂,故D正确.
故选A.
点评 本题考查物质的性质及用途,为高频考点,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| B | 向浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
| C | 取少量淀粉水解液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,出现砖红色沉淀 | 淀粉已完全水解 |
| D | 在CuSO4溶液中加入KI溶液,再加入苯,振荡,有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(正)减小,v(逆)增大 | B. | v(正)增大,v(逆)减小 | C. | v(正)、v(逆)都减小 | D. | v(正)、v(逆)都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
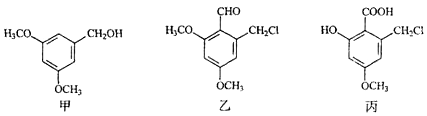
| A. | 甲、乙均能发生加成反应 | |
| B. | 甲的一种同分异构体中可能含有苯环和羧基 | |
| C. | 甲分子中的所有原子可能共平面 | |
| D. | 用酸性KMnO4溶液可鉴别乙和丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 候氏制碱、制取肥皂的工艺过程中均应用了物质溶解度的差异 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦提取青蒿素的过程中发生了化学变化 | |
| C. | “外观如雪,强烧之,紫青烟起”,南北朝陶弘景对硝酸钾的鉴定过程中利用了焰色反应 | |
| D. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发、结晶与蒸发皿 | B. | 过滤与漏斗 | ||
| C. | 萃取、分液与分液漏斗 | D. | 蒸馏与蒸馏装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微电池的负极是Mg | B. | 微电池的负极是Al | ||
| C. | 铝的电极反应式为2H++2e-═H2↑ | D. | 镁的电极反应式为Mg-2e-═Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com