
| A. | 不容易腐蚀 | B. | 比较硬 | C. | 强度大 | D. | 密度小 |
分析 复合材料是以一种材料为基体,另一种材料为增强体组合而成的材料.各种材料在性能上互相取长补短,产生协同效应,使复合材料的综合性能优于原组成材料而满足各种不同的要求.据此分析其性质的优点.
解答 解:复合材料是以一种材料为基体,另一种材料为增强体组合而成的材料.各种材料在性能上互相取长补短,产生协同效应,使复合材料的综合性能优于原组成材料而满足各种不同的要求.玻璃钢作为一种由玻璃纤维和合成树脂组成的复合材料,其化学稳定性好,耐腐蚀,硬度高,强度好,而且密度较小,在生活中有广泛的用途,故答案为:ABCD.
点评 本题考查了复合材料的优点,应注意从复合材料的组成来分析,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 滴定过程中视线应一直注视锥形瓶内混合液颜色的变化 | |
| D. | 用酚酞做指示剂,溶液由无色变浅红色,半分钟不变色为滴定终点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 标准状况下,22.4L己烷中共价键数目为19NA | |
| C. | 1L浓度为1 mol/L的Na2CO3溶液中含有NA个CO32- | |
| D. | 由CO2和O2组成的混合物中共有NA个分子,其中氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
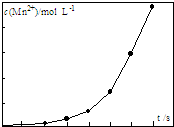 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 废旧塑料--回收再利用 | B. | 医疗垃圾--焚烧 | ||
| C. | 厨余垃圾--堆肥 | D. | 废旧电池--填埋 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | W的金属性是同主族元素中最强的 | |
| B. | X、Z形成的化合物为离子化合物 | |
| C. | X最高价氧化物对应的水化物的酸性小于Z的最高价氧化物对应的水化物 | |
| D. | 原子半径Y>Z,离子半径Y3+<Z2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 504 mL | B. | 168 mL | C. | 224 mL | D. | 336 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
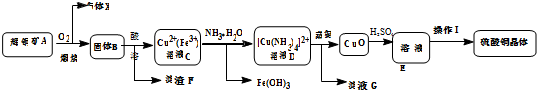
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com