
下列叙述Ⅰ和叙述Ⅱ均正确且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
| B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4===CuS↓+H2SO4可以发生 |
| C | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
| D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如下图Ⅰ~Ⅳ所示。
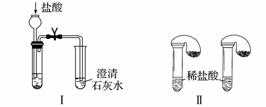
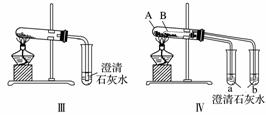
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________________________________________________________________________
(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为________________________________________________________________________;
与实验Ⅲ相比,实验Ⅳ的优点是________(填选项序号)。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________________________________________________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊溶液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 制得。实验室模拟该工业过程的装置如图所示。回答下列问题:

(1)b中反应的离子方程式为__________________________________,
c中试剂为____________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________。
(3)d中的试剂为______________。
(4)实验中要控制SO2生成速率,可以采取的措施有
________________________________________________________________________
___________________________________________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于硫及其化合物的说法中正确的是( )
A.自然界中不存在游离态的硫
B.二氧化硫的排放会导致光化学烟雾的产生
C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
D.浓硫酸可用来干燥SO2、CO、Cl2等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中几种常见物质的转化关系如下图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。

请回答下列问题:
(1)A、C的化学式分别为A__________,C__________。
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是________(填字母)。
A.C+2H2SO4(浓)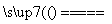 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4===FeSO4+H2↑
C.Cu+2H2SO4(浓)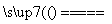 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.FeO+H2SO4===FeSO4+H2O
(3)写出反应E+H2O2—→F的化学方程式:_______________________________________。
(4)若反应F+D—→E转移电子数为6.02×1023,则消耗D的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、M五种元素位于周期表的前四周期,原子序数依次增大,其中X元素是宇宙中最丰富的元素,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,M含有未成对电子数最多的元素。请回答下列问题。
(1)Y、Z、W的电负性由小到大的顺序为______________。
(2)M原子的外围电子排布式为_____。
(3) X2W2分子中W原子轨道的杂化类型为________。
(4)Z与W可形成的一种ZW3-阴离子,与其互为等电子体的阴离子为___(任写一种)。
(5)MCl3能与Z、W的氢化物形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,氯离子全部位于外界。则该配合物的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对晶体类型判断正确的是( )
| 选项 | Na2B2O7 | CaF2 | H3BO3 | NH3 |
| A | 原子晶体 | 金属晶体 | 原子晶体 | 分子晶体 |
| B | 离子晶体 | 分子晶体 | 离子晶体 | 分子晶体 |
| C | 离子晶体 | 离子晶体 | 分子晶体 | 分子晶体 |
| D | 分子晶体 | 离子晶体 | 分子晶体 | 离子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com