
分析 电离度=$\frac{电离浓度}{原浓度}$×100%,所以4.24%=$\frac{c({H}^{+})}{0.01}$,据此分析计算.
解答 解:电离度=$\frac{电离浓度}{原浓度}$×100%,所以4.24%=$\frac{c({H}^{+})}{0.01}$,c(H+)=4.24×10-4mol/L,则c(Ac-)=4.24×10-4mol/L,电离平衡时c(HAc)=0.01mol/L-4.24×10-4mol/L,所以醋酸的电离平衡常数K=$\frac{[{H}^{+}]•[A{c}^{-}]}{[HAc]}$=$\frac{4.24×1{0}^{-4}×4.24×1{0}^{-4}}{0.01-4.24×1{0}^{-4}}$=1.8×10-5,故答案为:醋酸的电离平衡常数为1.8×10-5;[H+]=4.24×10-4mol/L.
点评 本题考查了弱酸的电离平衡常数的计算和离子浓度的计算,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
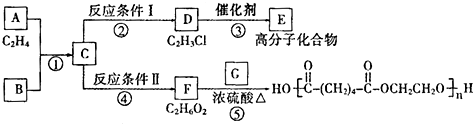
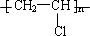 ,GHOOC(CH2)4COOH;
,GHOOC(CH2)4COOH;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、SiO32-、NO3- | |
| B. | 0.1 mol•L-1 Na2CO3溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 0.1 mol•L-1NaClO溶液:Na+、NH4+、SO32-、CO32- | |
| D. | 0.1 mol•L-1Na[Al(OH)4]溶液:K+、Na+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹化银难溶于水,见光容易分解 | |
| B. | H20、H2S、H2Se随着相对分子质量的增大,沸点逐渐升高 | |
| C. | 因为H2C03比H2Si03酸性强,所以将C02通入N2SiC3溶液中有H2Si03沉淀生成 | |
| D. | 铝和铊同属第IIIA族元素,但氢氧化铊[Tl(OH)3]不一定呈两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | AlCl3溶液中加过量氨水:Al3++4NH3•H2O═AlO2-↓+4NH4++2H2O | |
| C. | 小苏打置于盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 过量CO2通入漂白粉溶液中:CO2+H2O+ClO-═HCO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 g钠与水反应产生氢气的分子数为0.05NA | |
| B. | 1 mol Fe与过量的稀HNO3反应,转移2NA个电子 | |
| C. | 0.1 mol/LNa2SO4溶液含有0.1NA个SO42- | |
| D. | 22.4 L氯气与足量铜充分反应,生成1 mol CuCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com