
以海水中常见物质A为原料可以发展很多工业生产,下图中包含了中学所学的几种基本工业生产,请根据下图各物质之间的转化关系回答下列问题。
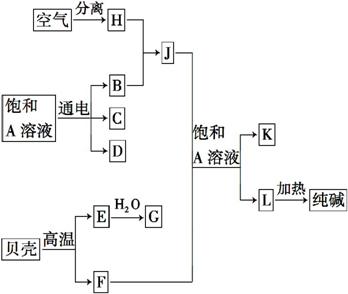
(1)C和D、C和G反应都可以制取消毒剂。写出C和G反应制取消毒剂的化学反应方程式: 。
(2)电解A溶液反应的离子方程式为 。若该反应中转移电子数为8NA,则产生的氯气在标准状况下体积为 L。
(3)实验室可用K与G固体加热制取J,写出该反应的化学方程式:___________
___________________________________________________________________。
(4)在制取L的反应过程中,向饱和A溶液先通入J,还是先通入F,其原因是___
___________________________________________________________________。
【解析】从图示工艺流程的转化看出,本题涉及的基本工业生产有:从空气中分离N2或O2、电解饱和食盐水、煅烧石灰石、合成氨、工业制漂白粉、侯氏制碱等,根据C和D、C和G反应都可以制取消毒剂,知C为Cl2,D为NaOH,G为Ca(OH)2,A为NaCl,B为H2,H为N2,J为NH3,E为CaO,F为CO2,L为NaHCO3,K为NH4Cl。显然,C和G反应制取的消毒剂是漂白粉。电解饱和食盐水反应中转移电子数为8NA,即8 mol,则生成4 mol Cl2 89.6 L。NH3实验室制法可用NH4Cl和Ca(OH)2共热制取。侯氏制碱过程中,因CO2溶解度较小,NH3溶解度较大,先通入NH3,后通入CO2,可以最大限度地溶解CO2,增大HC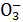 的浓度,使反应向生成NaHCO3的方向进行,有利于NaHCO3晶体析出。
的浓度,使反应向生成NaHCO3的方向进行,有利于NaHCO3晶体析出。
答案:(1)2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O
(2)2Cl-+2H2O 2OH-+H2↑+Cl2↑ 89.6
2OH-+H2↑+Cl2↑ 89.6
(3)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(4)先通入NH3,后通入CO2,因CO2溶解度较小,NH3溶解度较大,先通入NH3可以最大限度地溶解CO2,增大HC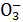 的浓度,使反应向生成NaHCO3的方向进行,有利于NaHCO3晶体析出
的浓度,使反应向生成NaHCO3的方向进行,有利于NaHCO3晶体析出
【方法技巧】化学工艺流程的知识有中学常见与工业生产有关的反应,如氯碱工业、工业制漂白粉、工业制硫酸、工业合成氨、氨的催化氧化、工业制硝酸、工业制粗硅、工业制纯碱、从海水中提取镁或溴、从海带提取碘、电解制镁或铝、电解精炼铜、煅烧石灰石等;也有中学未学过的给出新信息的化学工艺流程,只要认真分析流程中每一步转化的反应原理和每一步操作的目的、作用,并将其作为解题的切入点,即可解决有关问题。


科目:高中化学 来源: 题型:
荧光素(X)常用于钞票等防伪印刷,下列关于它的说法正确的是 ( )
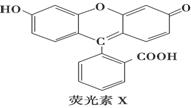
A.1 mol X与足量的NaOH溶液在常温常压下反应,最多消耗3 mol NaOH
B.1 mol X最多能与9 mol氢气反应
C.X能与糠醛(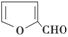 )发生缩聚反应
)发生缩聚反应
D.1 mol X与足量的浓溴水反应,最多消耗4 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是( )
①w=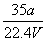 ×100% ②c=
×100% ②c=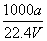
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w
④向上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为c(Cl-)>c(NH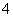 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
2012年“六·五”世界环境日主题:“绿色消费,你行动了吗?”旨在强调绿色消费的理念,选择绿色产品。以下叙述与此理念不相符的是( )
①在食盐中加入适量碘酸钾防治碘缺乏症
②用工业酒精兑制饮用酒以降低成本
③用活性炭来脱色以制白糖
④加工香肠时任意加入亚硝酸钠以保持肉类新鲜
⑤做馒头时加入适量纯碱或碳酸氢钠使馒头松软
A.②和④ B.①和③ C.③和⑤ D.②和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
A.“天宫”一号中使用的碳纤维,是一种新型有机高分子材料
B.为改善食品的色、香、味并防止变质,可加入大量食品添加剂
C.用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
D.大量使用化肥和农药,以提高农作物产量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置用途正确的是
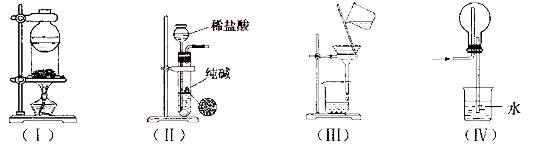
A.装置(I)用于I2与NH4Cl混合物的分离
B. 装置(Ⅱ)用于制取少量纯净的CO2气体
C.装置(III)用于去除Fe(0H)3胶体中含有的可溶性物质
D.装置(Ⅳ)用于HC1的吸收,以防倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
四氯化锡是无色液体,熔点-33"C,沸点114℃。氯气与金属锡在加热时反应可以用来制备SnCl4 ,SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过题1O图装置制备少量SnCl4 (夹持装置略)。
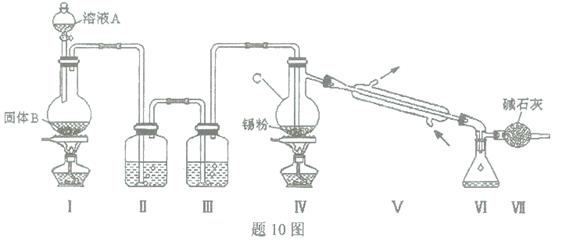
(1)仪器C的名称为 ;
(2)装置Ⅰ中发生反应的离子方程式为 ;
(3)装置Ⅱ中的最佳试剂为 ,装置Ⅶ的作用为 ;
(4)若装置连接顺序为Ⅰ—Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4 外,还会生成的含锡的化合物的化学式为 。
(5)Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为 ;
(6)若Ⅳ中用去锡粉11.9 g,反应后,Ⅵ中锥形瓶里收集到23.8 g SnCl4 ,则SnCl4 的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)===CO2(g) ΔH=E1①
b.C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2②
H2(g)+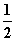 O2(g)===H2O(g) ΔH=E3③
O2(g)===H2O(g) ΔH=E3③
CO(g)+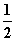 O2(g)===CO2(g) ΔH=E4④
O2(g)===CO2(g) ΔH=E4④
回答:
(1)上述四个热化学方程式中的哪些反应ΔH<0?
________________________________________________________________________。
(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是( )
A.a比b多 B.a比b少 C.a与b在理论上相同
(3)根据能量守恒定律,E1、E2、E3、E4之间的关系为________________________
________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com