
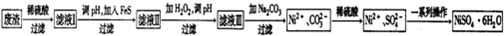
分析 (1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,Ce元素的化合价由+4价降低为+3价;
(2)从质量守恒、电荷守恒和电子守恒的角度配平方程式;
(3)根据电子和离子的定向移动方向判断电极;放电时,电池的正极发生还原反应,被CoO2还原生成LiCoO2;
(4)①加入FeS,可转化为溶解度更小的难溶电解质;
②Fe3++3H2O?Fe(OH)3+3H+,25℃时Ksp[Fe(OH)3]=2.8×10-39,Ksp=c(Fe3+)×c3(OH-),Kw=c(H+)×c(OH-),则K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$×$\frac{{c}^{3}(O{H}^{-})}{{c}^{3}(O{H}^{-})}$=$\frac{K{w}^{3}}{Ksp}$;
③滤液Ⅱ中含有Fe2+,可与过氧化氢发生氧化还原反应生成Fe3+,调节pH,可有利于Fe3+的水解.
解答 解:(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,Ce元素的化合价由+4价降低为+3价,则CeO2在反应中作氧化剂,
故答案为:氧化;
(2)反应中Cr元素化合价由+6价降低到+3价,S元素化合价由+4价升高到+6价,则最小公倍数为12,由电子守恒和原子守恒、电荷守恒可知配平后的离子方程式为Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H20,
故答案为:1;3;8H+;2;3;4;
(3)反应中电子向C6极移动,如C6为负极,则移向C6的离子应为阴离子,而移向C6的为阳离子,则C6应为阴极,此时该电池处于充电状态,放电时,电池的正极发生还原反应,被CoO2还原生成LiCoO2,电极方程式为CoO2+Li++e-=LiCoO2,
故答案为:CoO2+Li++e-=LiCoO2;
(4)①向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,说明CuS的溶解度更小,反应的离子方程式为FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq),
故答案为:FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq);
②Fe3++3H2O?Fe(OH)3+3H+,25℃时Ksp[Fe(OH)3]=2.8×10-39,Ksp=c(Fe3+)×c3(OH-),Kw=c(H+)×c(OH-),则K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$×$\frac{{c}^{3}(O{H}^{-})}{{c}^{3}(O{H}^{-})}$=$\frac{K{w}^{3}}{Ksp}$;
则K=$\frac{K{w}^{3}}{Ksp}$=$\frac{(1{0}^{-14})^{3}}{2.8×1{0}^{-39}}$=3.6×10-4,
故答案为:3.6×10-4;
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4,可增大成NiSO4浓度,有利于蒸发结晶,
故答案为:增大NiSO4浓度,有利于蒸发结晶.
点评 本题考查较为综合,涉及氧化还原反应、盐类的水解、物质的分离提纯以及原电池知识,侧重于学生的分析能力和实验能力、计算能力的考查,为高频考点和常见题型,题目难度中等,注意把握基础知识的积累.


科目:高中化学 来源: 题型:填空题
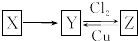 X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 | |
| B. | LiAlH4与D2O反应,所得氢气的摩尔质量为4 g•mol-1 | |
| C. | 1 mol LiAlH4在125℃完全分解,转移3 mol电子 | |
| D. | LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O═Al(OH)3↓+LiOH+4H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶、烧杯外还需要的其它玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上可利用空气冷冻成液体后再分离来获得液氧 | |
| B. | 煤油燃烧后的主要产物是水和二氧化碳,绿色环保 | |
| C. | 煤油属于纯净物.主要成分是烃 | |
| D. | 火箭装载的燃料越多,说明其动力越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将滴管伸入试剂瓶中,然后用手指头捏紧橡胶乳头,赶走滴管中的空气 | |
| B. | 向烧杯内滴加试剂时,将滴管悬空放在烧杯上方,将试剂滴下 | |
| C. | 取液后的滴管保持橡胶乳头在上,不可倒置或平放 | |
| D. | 除滴瓶上的滴管外,用过的滴管应立即用清水冲洗干净 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com