
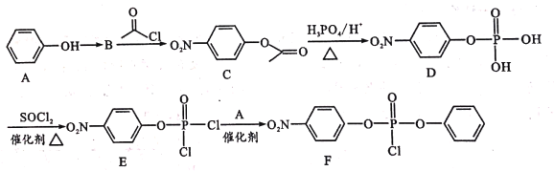
【题目】据研究报道,药物瑞德西韦(Remdesivir)对2019年新型冠状病毒(COVID-19)有明显抑制作用。F为药物合成的中间体,其合成路线如下:
已知:R-OH![]() R-Cl
R-Cl
(1)A中官能团名称是________;C的分子式为_____
(2)A到B为硝化反应,则B的结构简式为___,A到B的反应条件是_____。
(3)B到C、D到E的反应类型 ________(填“相同”或“不相同”);E→F的化学方程式为________ 。
(4)H是C的同分异构体,满足下列条件的同分异构体有_____种。
①硝基直接连在苯环上
②核磁共振氢谱峰面积之比为2:2:2:1
③遇FeCl3溶液显紫色
(5)参照F的合成路线图,设计由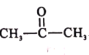 、SOCl2为原料制备
、SOCl2为原料制备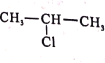 的合成路线_______(无机试剂任选)。
的合成路线_______(无机试剂任选)。
【答案】酚羟基 C8H7NO4 ![]() 浓硫酸、浓硝酸、加热 相同 :
浓硫酸、浓硝酸、加热 相同 :![]() +
+![]()
![]()
![]() +HCl 2
+HCl 2 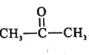 +H2
+H2![]()
![]()
![]()
【解析】
根据流程图,A在浓硫酸、浓硝酸、加热条件下发生取代反应生成B,B的结构简式为![]() ,B和
,B和![]() 发生取代反应生成C(
发生取代反应生成C(![]() ),C和磷酸在加热条件下发生取代生成D,D在SOCl2、催化剂、加热条件下转化为E(
),C和磷酸在加热条件下发生取代生成D,D在SOCl2、催化剂、加热条件下转化为E( ),E与A发生被取代转化为F,根据E、F的结构简式可判断,A的结构简式为
),E与A发生被取代转化为F,根据E、F的结构简式可判断,A的结构简式为![]() ,据此分析答题。
,据此分析答题。
(1)根据流程图中A的结构简式分析,官能团名称是羟基;根据图示C中的每个节点为碳原子,每个碳原子连接4个共价键,不足键由氢原子补齐,则分子式为C8H7NO4;
(2)A到B为硝化反应,根据分析,B的结构简式为![]() ,A到B的反应条件是浓硫酸、浓硝酸、加热;
,A到B的反应条件是浓硫酸、浓硝酸、加热;
(3)根据分析,B和![]() 发生取代反应生成C(
发生取代反应生成C(![]() ),C和磷酸在加热条件下发生取代生成D,则B到C、D到E的反应类型相同;E与A发生被取代转化为F, A的结构简式为
),C和磷酸在加热条件下发生取代生成D,则B到C、D到E的反应类型相同;E与A发生被取代转化为F, A的结构简式为![]() ,化学方程式为:
,化学方程式为:![]() +
+![]()
![]()
![]() +HC;
+HC;
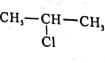
(4)C的结构简式为 ![]() ,H是C的同分异构体, ①硝基直接连在苯环上,②核磁共振氢谱峰面积之比为2:2:2:1,说明分子结构中含有4中不同环境的氢原子,且氢原子的个数比为2:2:2:1,③遇FeCl3溶液显紫色,说明结构中含有酚羟基,根据不饱和度可知,还存在CH=CH2,满足下列条件的同分异构体结构简式为
,H是C的同分异构体, ①硝基直接连在苯环上,②核磁共振氢谱峰面积之比为2:2:2:1,说明分子结构中含有4中不同环境的氢原子,且氢原子的个数比为2:2:2:1,③遇FeCl3溶液显紫色,说明结构中含有酚羟基,根据不饱和度可知,还存在CH=CH2,满足下列条件的同分异构体结构简式为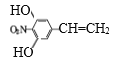 、
、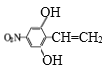 ,共有有2种;
,共有有2种;
(5)  与氢气在催化剂作用下发生加成反应生成
与氢气在催化剂作用下发生加成反应生成![]() ,
,![]() 在SOCl2、催化剂、加热条件下转化为
在SOCl2、催化剂、加热条件下转化为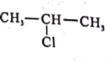 ,则合成路线为:
,则合成路线为: +H2
+H2![]()
![]()
![]()
 。
。


科目:高中化学 来源: 题型:
【题目】在乏燃料后处理流程中,四价铀作为铀钚分离的还原剂己广泛使用。在UO2(NO3)-2HNO3-N2H4。HNO3体系下采用电解法制备四价铀,电解总反应为2UO22++N2H5++3H+![]() 2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是
2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是
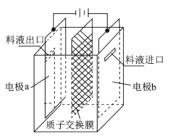
A.若转移4mol e-,将有4mol H+透过质子交换膜
B.b极的电极反应式为UO22++2H2O+2e-=U4++4OH-
C.电解液中NO3-的移动方向:a→质子交换膜→b
D.当产生11.2 mL N2时,同时生成U4+的质量为0.2389
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期元素,请根据下表信息回答问题。
元素 | A | B | C | D |
性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
(1)B在元素周期表的位置:___;B气态氢化物的电子式___。
(2)C的最高价氧化物分别与强酸、强碱反应的离子方程式为___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
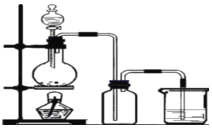
【题目】实验室制备氯气并检验氯气性质实验的装置如图。请回答:
(1)分液漏斗中盛放的液体是_____;写出圆底烧瓶中发生的反应的化学方程式_____。
(2)在集气瓶中放入湿润的红布条,滴加液体到烧瓶中,并点燃酒精灯,一段时间后集气瓶中观察到的现象是_____,烧杯中的液体是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
实验目的 | 实验操作 | |
A | 制备 | 将 |
B | 由 | 将 |
C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
D | 配制 | 将氯化铁固体溶于盐酸中 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
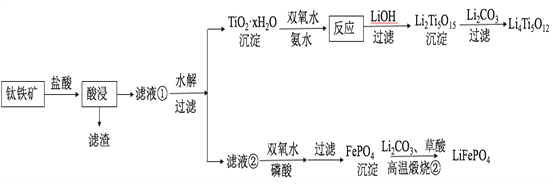
回答下列问题:
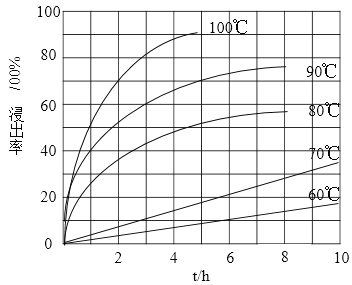
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1mol/LNaAlO2溶液:![]() 、
、![]() 、
、![]() 、
、![]()
B. pH=11的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C. 无色溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D. 使pH试纸变红的溶液中:Fe2+、SO42-、NO3-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅孔雀石是一种含铜矿石,含铜形态为![]() 和
和![]() ,同时含有
,同时含有![]() 、
、![]() 、
、![]() 、
、![]() 等杂质。以其为原料制取硫酸铜的工艺流程如图:
等杂质。以其为原料制取硫酸铜的工艺流程如图:

(1)将硅孔雀石研磨成粉的目的:__________________;步骤①中稀硫酸与![]() 反应的化学方程式:__________________。
反应的化学方程式:__________________。
(2)双氧水的作用是__________________;滤渣![]() 的主要成分为__________________。
的主要成分为__________________。
(3)步骤②调节溶液![]() ,可以选用的试剂是______。
,可以选用的试剂是______。
A. CuO B. NaOH C.Al2O3 D. Cu(OH)2
(4)有关氢氧化物开始沉淀和完全沉淀的![]() 如下表:
如下表:
氢氧化物 |
|
|
|
|
开始沉淀的 | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的 | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节![]() ,所得滤渣
,所得滤渣![]() 的成分的化学式为____________,滤液
的成分的化学式为____________,滤液![]() 中除
中除![]() 外,还含有的金属阳离子是______。
外,还含有的金属阳离子是______。
(5)将滤液![]() 通过____________操作可得到五水硫酸铜晶体。测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果______(填“偏高”、“偏低”或“不变”)。
通过____________操作可得到五水硫酸铜晶体。测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果______(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液 只含Cl-、![]() 、SO4 2-、Na+、K+、Mg2+六种离子中的某几种。经实验:
、SO4 2-、Na+、K+、Mg2+六种离子中的某几种。经实验:
①原溶液加过量的 NaOH 溶液,产生白色沉淀;
②过滤,取实验①滤液加 BaCl2 溶液不产生沉淀;
③取实验①滤液加稀硝酸酸化,再加 AgNO3 溶液产生白色沉淀, 下列说法不正确的是
A.实验 ① 中的白色沉淀为 Mg(OH)2
B.实验②证明原溶液中一定没有 CO3 2-、SO4 2-
C.原溶液中一定含有的离子是 Cl-、Na+、K+、Mg2+
D.有同学认为原溶液一定有 Cl-,实验③可以省略
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com