
| A. | 只有①② | B. | 只有②③ | C. | 只有①②③ | D. | 全部正确 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
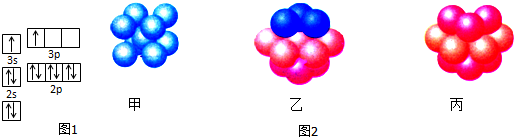
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
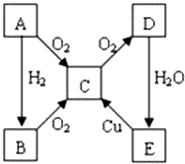 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.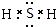 ;
;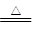 CO2↑+2SO2↑+2H2O.
CO2↑+2SO2↑+2H2O.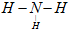 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和滴定中,既可用标准溶液滴定待测溶液,也可用待测溶液滴定标准溶液 | |
| B. | 进行中和滴定操作中,眼睛要始终注视滴定管内溶液液面的变化 | |
| C. | 测定中和热时,两烧杯间填满碎纸的作用是固定小烧杯 | |
| D. | 若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.50mo1•L-1的硫酸充分反应,两反应的中和热不相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com