
| A. | 向0.1mol•L-1氨水中加入少量水,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减少 | |
| B. | 将NH4Cl溶液从20℃升温至30℃,溶液中$\frac{c(N{H}_{4})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 | |
| C. | 向氢氧化钠溶液中加入醋酸至中性,溶液中$\frac{c(C{H}_{3}COO)}{c(N{a}^{+})}$=1 | |
| D. | 向含有BaSO4、BaCO3的饱和溶液中加入少量的Ba(NO3)2,溶液中的$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$减小 |
分析 A、向0.1mol•L-1氨水中加入少量水,促进氨水的电离,所以一水合氨的物质的量减少,氢氧根离子的物质的量增加;
B、将NH4Cl溶液从20℃升温至30℃,促进水解,所以铵根离子的浓度减少,一水合氨和氢离子的浓度变大,则$\frac{c(N{H}_{4})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$的减小;
C、向氢氧化钠溶液中加入醋酸至中性则c(H+)=c(OH-),根据电荷守恒,说明c(CH3COO-)=c(Na+);
D、在$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$的分子和分母同乘以钡离子的浓度,即为:$\frac{{K}_{sp(BaS{O}_{4})}}{Ksp(BaC{O}_{3})}$.
解答 解:A、向0.1mol•L-1氨水中加入少量水,促进氨水的电离,所以一水合氨的物质的量减少,氢氧根离子的物质的量增加,所以溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大,故A错误;
B、将NH4Cl溶液从20℃升温至30℃,促进水解,所以铵根离子的浓度减少,一水合氨和氢离子的浓度变大,则$\frac{c(N{H}_{4})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$的减小,而不是增大,故B错误;
C、向氢氧化钠溶液中加入醋酸至中性则c(H+)=c(OH-),根据电荷守恒,说明c(CH3COO-)=c(Na+),所以溶液中$\frac{c(C{H}_{3}COO)}{c(N{a}^{+})}$=1,故C正确;
D、在$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$的分子和分母同乘以钡离子的浓度,即为:$\frac{{K}_{sp(BaS{O}_{4})}}{Ksp(BaC{O}_{3})}$,而溶度积是温度的函数,温度不变,比值不变,故D错误;
故选C.
点评 本题考查弱电解质平衡的移动,涉及沉淀的生成、电荷守恒的应用,注重基础知识的考查,题目难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:推断题
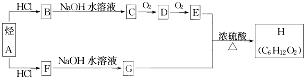
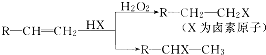
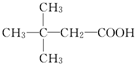 .(用结构简式表示)
.(用结构简式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中提取镁 | B. | 用酒精测试仪检测酒驾 | ||
| C. | 将氯气通入冷的消石灰中制漂白粉 | D. | 石油分馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
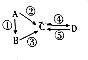
| 物质 | A | B | C | D |
| 元素种类 | 1 | 2 | 3 | 3 |
 ,物质C的化学式是HClO,写出反应A→D的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
,物质C的化学式是HClO,写出反应A→D的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O | |
| B. | 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2-+2H2O | |
| C. | 向NaHCO3溶液中滴加盐酸:CO32-+2H+=H2O+CO2↑ | |
| D. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H10O2的酯有9种结构 | B. | 异丁烷的一氯代物有2种 | ||
| C. | 淀粉和纤维素互为同分异构体 | D. | C9H12含苯环的烃有8种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com