
| A. | 热稳定性:纯碱>石灰石>小苏打>碳酸 | |
| B. | 除Li外其它碱金属单质均可以保存在煤油中 | |
| C. | 碱金属都是活泼的金属元素,其盐都不发生水解 | |
| D. | 最高氧化物对应水化物碱性LiOH<NaOH<KOH<RbOH<CsOH |
分析 A、碳酸钙加热会分解成氧化钙和二氧化碳,碳酸氢钠加热会分解生成碳酸钠,水和二氧化碳;碳酸钠加热不分解,所以碳酸钠的热稳定性最好;碳酸氢钠加热到150°时就会分解,而碳酸钙要加热到800°以上才会分解,所以碳酸钙的热稳定性次于碳酸钠,而碳酸常下就分解;
B、锂的密度比煤油的密度小;
C、如果形成盐对应的酸根是弱离子,则能水解;
D、同主族元素从上往下金属性增强,最高价氧化物对应水化物的碱性增强.
解答 解:A、碳酸钙加热会分解成氧化钙和二氧化碳,碳酸氢钠加热会分解生成碳酸钠,水和二氧化碳;碳酸钠加热不分解,所以碳酸钠的热稳定性最好;碳酸氢钠加热到150°时就会分解,而碳酸钙要加热到800°以上才会分解,所以碳酸钙的热稳定性次于碳酸钠,而碳酸常下就分解,所以稳定性为:纯碱>石灰石>小苏打>碳酸,故A正确;
B、锂的密度比煤油的密度小,不能保存在煤油中,其它碱金属的密度都水大,可以保存在煤油中,故B正确;
C、如果形成盐对应的酸根是弱离子,则能水解,如碳酸钠和碳酸氢钠等,故C错误;
D、金属性:Li<Na<K<Rb<Cs,所以碱性:LiOH<NaOH<KOH<RbOH<CsOH,故D正确;
故选C.
点评 本题考查碱金属的化学性质,为高频考点,把握碱金属性质的递变规律为解答的关键,注意原子结构决定性质,明确元素周期律的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
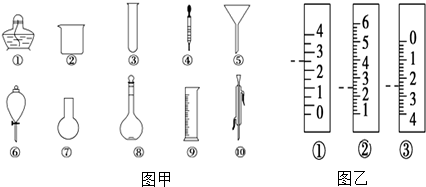
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
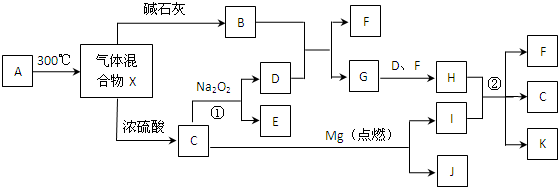
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
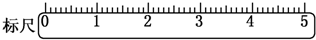 实验课上配制500mL 0.5mol/L的NaOH溶液,试回答下列问题.
实验课上配制500mL 0.5mol/L的NaOH溶液,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有相同数目的原子 | B. | 都占22.4 L | ||
| C. | 具有相同数目的分子 | D. | 具有相同摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成了氢氧化铁沉淀 | |
| B. | 体系中存在着氢氧化铁的沉淀溶解平衡 | |
| C. | 溶液中不再存在Fe3+ | |
| D. | 加入少量盐酸,则溶液中Fe3+浓度会上升 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳纤维增强复合材料可用于人体组织中韧带的制作 | |
| B. | 氮化硅陶瓷是新型无机非金属材料 | |
| C. | 银、铜、铁都是有色金属材料 | |
| D. | 碳化硅陶瓷具有压电效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com