
【题目】浓度为2.00 mol/L的盐酸溶液1L,欲使其浓度变为4.00mol/L,下列方法可行的是( )
A. 蒸发掉0.5L水 B. 标况下通入44.8L HCl气体
C. 将溶液加热蒸发浓缩至0.5L D. 加入10mol/L盐酸0.6L,再将溶液稀释至2L
科目:高中化学 来源: 题型:
【题目】2017年我国首次海域可燃冰(甲烷的结晶水合物)试采成功。关于甲烷的结构与性质说法正确的是( )
A.是平面正方形分子B.能与强酸、强碱反应
C.能与氯气在光照条件下反应D.能使高锰酸钾酸性溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜锌原电池(稀硫酸作电解质溶液)的叙述错误的是( )
A.电子由正极通过导线流向负极
B.负极反应式为:Zn﹣2e﹣=Zn2+
C.正极产生1molH2电池转移2mol电子
D.可以用碳棒代替铜片作为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科大陈乾旺教授等人发明![]() 合成金刚石的新方法,化学原理为:①
合成金刚石的新方法,化学原理为:①![]() (未配平)该方法比1955年人工首次制得金刚石的旧方法容易得多。②
(未配平)该方法比1955年人工首次制得金刚石的旧方法容易得多。②![]() 。以下表述正确的是( )
。以下表述正确的是( )
A. 反应①中既有旧化学键的断裂又有新化学键的形成
B. 新方法利用的是物理变化,旧方法利用的是化学变化
C. 在反应①中每生成![]() 金刚石需要消耗
金刚石需要消耗![]() 金属钠
金属钠
D. 反应①和反应②中所得的金刚石都是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下HF的电离常数Ka=3.3×10-4 ,CaF2的溶度积常数Ksp=1.46×10-10。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是
A. 该温度下,0.31 mol·L-1的HF溶液的pH=2
B. 升高温度或增大浓度,HF的电离平衡常数都将增大
C. 两溶液混合不会产生沉淀
D. 向饱和的CaF2溶液中加入少量CaCl2固体后,溶度积常数Ksp一定比之前减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】借助下表提供的信息,实验室制备乙酸丁酯所采取的措施正确的是
物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 |
沸点 | 117.9℃ | 117.2℃ | 126.3℃ |
A. 采用水浴加热 B. 使用浓硫酸做催化剂
C. 用NaOH(aq)洗涤产物后分液 D. 边制备边蒸出乙酸丁酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组在实验室利用直接合成法制各甘氨酸亚铁。有关物质性质如下所示:
甘氨酸( NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇、 | 易溶于水和乙醇, | 易溶于水, |
两性化合物 | 有强酸性和还原性 | 难溶于乙醇 |
实验过程及装置图如下(夹持和加热仪器已省略):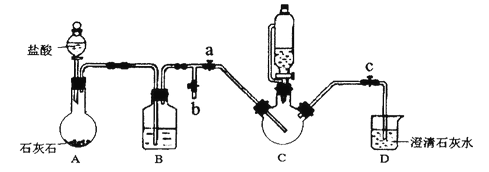
I.合成:在C中加入0.10mol甘氨酸、0.05mol硫酸亚铁、少量柠檬酸和200mL水,利用CO2将C装置中的空气排净,然后在40℃恒温条件下用磁力搅拌器不断搅拌,并用恒压滴液漏斗向C中滴加6mol·L-1NaOH溶液调节pH到6左右,使反应物充分反应。
II.分离:加入无水乙醇,立即出现白色沉淀。将沉淀进行过滤、洗涤,收集滤渣。
Ⅲ.提纯:将滤渣溶解于适量的蒸馏水中,然后结晶、过滤,将纯化后的产品放入真空干燥箱中干燥后称重。
回答下列问题:
(1)B装置的作用是______________;
(2)能证明C装置中空气排净的现象是______________;向C中滴加NaOH溶液之前应该停止滴加盐酸,且关闭止水夹____________,打开止水夹________
(3)“合成”中加入柠檬酸的作用是______________:请写出合成甘氨酸亚铁的化学方程式_________。
(4)加入乙醇的目的是________;“提纯”时用的结晶方法为________________
(5)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于FeSO4溶液。暴露在空气中,(NH2CH2COO)2Fe溶液比FeSO4溶液难被氧化,请分析原因为________
(6)若产品质量为ag,则产率为________ %。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.在共价化合物中一定含有共价键
B.含有共价键的化合物一定是共价化合物
C.含有离子键的化合物一定是离子化合物
D.全部由非金属组成的化合物可能是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com