
【题目】下列说法正确的是 ( )
A. ![]() 比
比![]() 沸点高
沸点高
B. O2-半径比![]() 的小
的小
C. Na和Cs属于第IA族元素,Cs失电子能力比Na的强
D. P和As属于第VA族元素, ![]() 酸性比
酸性比![]() 的弱
的弱
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:

已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O=Na2A12Si2O8↓+4NaOH。请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为_________________________________。
(2)在工艺流程中“酸化”时,加入的最佳物质B是________,理由是_______________________,写出酸化过程发生反应的化学方程式:________________________________。
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为__________________________________。
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是_________(填化学式),请判断该同学设计的实验方案的合理性_________(填“合理”或“不合理”)。原因是_______________________________________(若合理,则不用填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EHPB是合成治疗高血压和充血性心力衰竭的药物的中间体,合成路线如下:
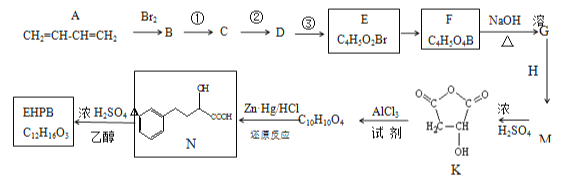
已知:ⅰ.碳碳双键容易被氧化
ⅱ. ![]()
(1)A的名称为______,E中含氧官能团的名称为_______。
(2)E由B经①、②、③合成。
a.①的反应试剂和条件是__。 b.③ 的反应类型是______。
(3)M的结构简式为__________。
(4)EHPB不能与NaHCO3反应,写出有机物N→EHPB的化学方程式为_____________。
(5)有机物N有多种同分异构体,其中能满足下列条件的同分异构体有_________种。
a.含有酚羟基 b.能发生水解反应且能发生银镜反应c.苯环上的一氯代物只有一种 d.核磁共振氢谱有5组峰
(6)请写出由苯和乙二醇制取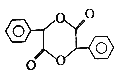 的转化过程________,无机试剂任选。
的转化过程________,无机试剂任选。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E,Y为短周期元素,且原子序数依次增大,A是周期表中原子半径最小的,B的原子序数为7,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。Y是短周期中原子序数最大的主族元素。
(1)W2-离子的结构示意图为__________,E元素在周期表中的位置为_________,写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式_______________________________。
(2)A2W2的电子式为__________,在酸性条件下A2W2可以将Fe2+氧化成Fe3+,写出该反应的离子方程式__________________________________________。当消耗2mol A2W2时,转移的电子数为____________________。
(3)下列事实能说明Y元素的非金属性比硫(S)元素的非金属性强的是__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4) 用电子式表示B的最简单氢化物的形成过程___________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断错误的是 ( )

A. NaOH的浓度为0.6 mol·L-1 B. 在a点处溶液中的溶质为NaCl
C. 混合溶液中n(Al3+)﹕n(Mg2+)=1﹕1 D. 图中线段oa : ab=4﹕1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 活化分子相互碰撞即可发生化学反应
B. 升高温度会加快化学反应速率,其原因是增加了活化分子的百分率
C. 某一反应的活化分子百分率是个定值
D. 浓度增大使得反应物分子中的活化分子百分率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A. 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 过氧化钠与反应:2O22-+2H2O=4OH-+O2↑
C. 碳酸氢钠与稀盐酸反应:CO32-+2H+=CO2↑+ H2O
D. 氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com