
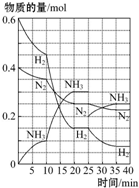
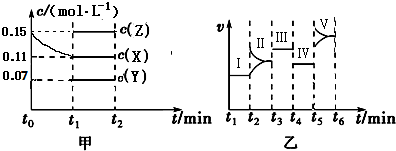
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A. | 反应开始到第一次平衡时,N2的平均反应速率为0.062 5 mol•L-1•min-1,H2的转化率为75% | |
| B. | 反应35 min时,达到第二次平衡时,反应的平衡常数:K=$\frac{0.1{5}^{2}}{0.07{5}^{3}•0.125}$ | |
| C. | 从曲线变化可以看出,反应进行到10~20 min时可能采取的措施是使用了催化剂 | |
| D. | 从曲线变化可以看出,反应进行至25 min时,采取的措施是分离出0.1 mol的氨气,平衡向正方向移动 |
分析 A.第一次平衡时,时间为20min,氮气的物质的量由0.4mol变为0.25mol,容器容积为2L,根据速率及其转化率公式可计算出氮气的速率;
B.反应达到第一次平衡时,c(NH3)=$\frac{0.3mol}{2L}$=0.15mol/L,c(H2)=$\frac{0.15mol}{2L}$=0.075mol/L,c(N2)=$\frac{0.25mol}{2L}$=0.125mol/L,然后根据平衡常数表达式计算;
C.根据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
D.25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;
解答 解:A.第一次平衡时,时间为20min,氮气的物质的量由0.4mol变为0.25mol,容器容积为2L,v(N2)=$\frac{△c}{△t}$=$\frac{0.4mol-0.25mol}{2L×20min}$=0.00375mol/(L•min),H2的转化率=$\frac{转化量}{总量}$×100%=$\frac{0.6-0.15}{0.6}$×100%=75%,故A错误;
B.反应达到第一次平衡时,c(NH3)=$\frac{0.3mol}{2L}$=0.15mol/L,c(H2)=$\frac{0.15mol}{2L}$=0.075mol/L,c(N2)=$\frac{0.25mol}{2L}$=0.125mol/L,所以K=$\frac{0.1{5}^{2}}{0.07{5}^{3}•0.125}$,故B正确;
C.由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2)=0.4-0.25=0.15mol,△n(H2)=0.6mol-0.15mol=0.45mol,△n(NH3)=0.3mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,故C正确;
D.25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,故D正确;
故选A.
点评 本题考查化学平衡的计算、平衡移动以及平衡状态的判断,题目难度中等,注意对图象的分析.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),是常用的解热镇痛药,实验室合成流程如下:
),是常用的解热镇痛药,实验室合成流程如下:

 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
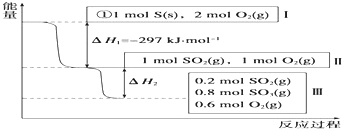
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cl2 | Br2 | I2 | H2 | HCl | HI | HBr |
| 键能/kJ•mol-1 | 243 | 193 | 151 | 436 | 431 | 298 | 366 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com