
若NA表示阿佛加德罗常数,下列说法正确的是 ( )
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C.14 g氮气中含有7 NA个电子
D.NA个一氧化碳分子和0.5 molCH4所含原子数相同
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型.回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下左图.下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是________.

(2)将NaBr溶液加入AgCl沉淀中,产生AgBr黄色沉淀.从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是________.
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2(已知2Na+2H2O===2NaOH+H2↑).
| 错误观点 | 离子方程式 | |
| ① | 所有的离子方程式均可以表示一类反应 | |
| ② | 所有酸碱中和反应均可表示为:H++OH-===H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组欲测定某品牌味精中氯化钠的含量。该小组的实验步骤如下:
①称取该味精样品10.0g放入烧杯中,并加适量蒸馏水完全溶解;
②加入过量的用硝酸酸化的硝酸银溶液(假定只有NaCl与AgNO3溶液反应)。
③过滤;
④用蒸馏水洗涤沉淀2~3次;
⑤将沉淀烘干、称量,测得其质量为5.74g;
请回答下列问题:
(1)上述实验步骤③操作中所用到的玻璃仪器有 。
(2)若此品牌味精包装袋上标注:“谷氨酸钠含量≥80.0% ,氯化钠含量≤20.0%”;(假设样品中不含其它杂质)。通过上述实验结果,可计算出样品中氯化钠的质量分数为 ,所以该样品 (填“合格”或“不合格”)。
(3)检验上述实验步骤④所得沉淀是否洗净的方法是:取最后一次洗涤液少量,
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对有关实验事实的解释正确的是
A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+
B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同
C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42
D.常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列氧化还原反应在溶液中均能发生。
①2Fe3++2I-=2Fe2++I2;②2Fe2++Br2=2Fe3++2Br-;③2Br-+Cl2=2Cl-+Br2。
(1)Fe2+、Br-、I-三种微粒按还原性由强到弱的顺序为____________________。
(2)现有某混合溶液中含a mol FeI2和b mol FeBr2,向该混合液中逐渐通入c mol Cl2,试根据以上化学原理分析,当只有I-被氧化时,c的取值范围是______________。
(3)某混合溶液中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4。向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是( )
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+
C.Ca(HCO3)2溶液与少量NaOH溶液反应:
HCO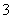 +Ca2++OH-=CaCO3↓+H2O
+Ca2++OH-=CaCO3↓+H2O
D.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的两份铝粉分别与等体积的盐酸和NaOH溶液反应,同温同压下产生的气体体积比为1︰1,则盐酸和NaOH溶液的物质的量浓度之比为( )
A.2︰3 B.3︰1 C.1︰2 D.1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究锌与稀硫酸的反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断正确的是(双选) ( )。
A.加入NH4HSO4固体,v(H2)不变
B.加入少量水,v(H2)减小
C.加入CH3COONa固体,v(H2)减小
D.滴加少量CuSO4溶液,v(H2)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后即对铁制品失去保护作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com