
科目:高中化学 来源: 题型:选择题
| 选 项 | 实验操作 | 实验现象 | 结论 |
| A | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有完全变质 |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红,下层溶液呈紫红色 实验现象2: 上层溶液变红 | 氧化性:Br2>Fe3+>I2 |
| C | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al的 |
| D | 取久置的绿矾(FeSO4•7H2O)溶于水,加入KSCN溶液 | 溶液变为红色 | 绿矾部分或全部被氧化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 剩余固体是铁、铜混合物 | |
| B. | 反应后溶液中n (Fe2+)+n(Cu2+)=0.75 mol | |
| C. | 反应后溶液中n (Fe3+)=0.10 mol | |
| D. | 原固体混合物中铜的质量是8.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移时,要用玻璃棒引流 | |
| B. | 托盘天平称取58.50克食盐,加水配制成1升溶液,NaCl溶液浓度为1mol•L-1 | |
| C. | 溶解食盐的烧杯要洗涤2~3次并将洗涤液转移到容量瓶中 | |
| D. | 搅拌可加速溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,若D最外层只有两个电子,则D的原子结构示意图
,若D最外层只有两个电子,则D的原子结构示意图 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
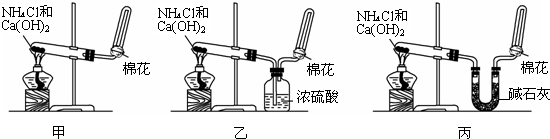
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com