
【题目】近年以来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式 .
②上述反应的平衡常数表达式K= , 根据上述信息判断,T1和T2的关系是 .
A.T1>T2 B.T1<T2 C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是 .
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2 , 具体流程如图1所示:
①用离子方程式表示反应器中发生的反应: .
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 .
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示.
通过a气体的电极是原电池的极(填“正”或“负”),b电极反应式为 .
【答案】
(1)C+2NON2+CO2;![]() ;C;cd
;C;cd
(2)SO2+I2+2H2O=SO42﹣+2I﹣+4H+;HI分解为可逆反应,及时分离出产物H2 , 有利于反应正向进行
(3)负;O2+4e﹣+4H+=2H2O
【解析】(1)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2 , 且该反应为可逆反应,故反应方程式为:C+2NON2+CO2 , 故答案为:C+2NON2+CO2;②从C+2NON2+CO2 , 则该反应的平衡常数表达式为K= ![]() ,由表中数据可知,温度由T1变为T2 , 平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:
,由表中数据可知,温度由T1变为T2 , 平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为: ![]() ;C;③a.增大c(NO),相当于增大压强,该反应前后气体的物质的量不变,平衡不移动,NO的转化率不变,故a错误;b.该反应前后气体的物质的量不变,增大压强,平衡不移动,NO的转化率不变,故b错误;c.反应移动存在热效应,升高温度,平衡一定移动,NO转化率一定变化,故c正确;d.移去部分生成物F,平衡向正反应移动,NO的转化率增大,故d正确;故答案为:cd;
;C;③a.增大c(NO),相当于增大压强,该反应前后气体的物质的量不变,平衡不移动,NO的转化率不变,故a错误;b.该反应前后气体的物质的量不变,增大压强,平衡不移动,NO的转化率不变,故b错误;c.反应移动存在热效应,升高温度,平衡一定移动,NO转化率一定变化,故c正确;d.移去部分生成物F,平衡向正反应移动,NO的转化率增大,故d正确;故答案为:cd;
(2)①反应器中二氧化硫、碘发生氧化还原反应生成硫酸和HI,离子反应为SO2+I2+2H2O=SO42﹣+2I﹣+4H+ , 故答案为:SO2+I2+ 2H2O=SO42﹣+2I﹣+4H+;②HI分解反应为可逆反应,则使用膜反应器分离出H2的目的是及时分离出产物H2 , 有利于反应正向进行,故答案为:HI分解为可逆反应,及时分离出产物H2 , 有利于反应正向进行;
(3)根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH﹣6e﹣+H2O=CO2+6H+ , 正极上氧气得电子发生还原反应,电极反应式为O2+4e﹣+4H+=2H2O,故答案为:负;O2+4e﹣+4H+=2H2O(1)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
②计算各气体的平衡浓度,代入平衡常数表达式计算;由表中数据可知,温度由T1变为T2 , 平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
③根据平衡移动原理分析解答,
a.增大c(NO),相当于增大压强,该反应前后气体的物质的量不变,平衡不移动;
b.该反应前后气体的物质的量不变,增大压强,平衡不移动;
c.反应移动存在热效应,升高温度,平衡一定移动;
d.移去部分生成物F,平衡向正反应移动;
(2)①反应器中二氧化硫、碘发生氧化还原反应生成硫酸和HI;
②HI分解反应为可逆反应;
(3)根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应.


科目:高中化学 来源: 题型:
【题目】分析原子的杂化方式,并根据等电子体原理判断下列各组分子中的所有原子,或者处于同一平面,或者在一条直线上的是( )
A.C2H2、HClO,C2H6
B.CO2、N2O,HC≡C﹣NH2
C.C6H5CH3、C3H4、CH4
D.C6H6、C2H4、HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取一定质量的纯碱溶于水中,与适量的盐酸作用,下列关于盐酸的用量和气体产量的变化是(填偏大、偏小、不变)
(1)若纯碱中混有K2CO3,盐酸用量将____________;气体产量将_______________。
(2)若纯碱中混有NaHCO3,盐酸用量将___________;气体产量将_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于溶液中离子的说法不正确的是( )
A.0.1mol?L﹣1的Na2CO3溶液中粒子浓度关系:c(Na+)═2c(CO ![]() )+2c(HCO
)+2c(HCO ![]() )+2c(H2CO3)
)+2c(H2CO3)
B.常温下,氢氧化钠溶液中滴入醋酸使溶液的pH=7,则混合溶液中醋酸已过量
C.0.2mol?L﹣1的HCl和0.1 mol?L﹣1的NH3?H2O等体积混合后溶液中的离子浓度关系:c(Cl﹣)>c (NH ![]() )>c(H+)>c (OH﹣)
)>c(H+)>c (OH﹣)
D.0.1mol?L﹣1的NaHS溶液中离子浓度关系:c(S2﹣)+c(OH﹣)═c(H+)+c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2的反应为4HCl(浓)+ MnO2![]() MnCl2 + C12↑ + 2H2O。下列说法不正确的是
MnCl2 + C12↑ + 2H2O。下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 mol Cl2,该反应转移电子的物质的量为2 mol
C. 每消耗1 mol MnO2,被氧化的HCl的物质的量为4 mol
D. 该反应中,HCl既表现还原性又表现酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.用100mL量筒量取1.3mL盐酸
B.配制氯化钠溶液时,用托盘天平称取8.55g氯化钠固体
C.容量瓶不能用作溶解物质的容器
D.粗盐的提纯试验中,滤液在坩埚中加热蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B. 强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物
C. 水难电离,纯水是弱电解质
D. 溶于水能导电的化合物中一定含有阴阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.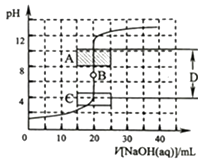
(1)为了准确绘制图2,在滴定开始时和 , 滴液速度可以稍快一点,测试和记录pH的间隔可大些;当接近时,滴液速度应该慢一些,尽量每滴一滴就测试一次.
(2)在图2中A区pH范围使用的指示剂是;C区pH范围使用的指示剂是;B点是;D区可称为 .
(3)现有两种稀溶液:标记为A的0.0100molL﹣1的氢氧化钠溶液:标记为B的0.100molL﹣1的盐酸.假设本题所涉及到的各种稀溶液的密度均近似为1.00gmL﹣1 , 且每滴溶液的体积近似为0.05mL.在盛有20.0mLA溶液的锥形瓶中滴加1滴酚酞试液,再用滴定管向锥形瓶中滴入10.0mLB溶液,边滴边振荡,充分混合后溶液呈无色.若取该无色混合液3.00mL于一支试管内,再向试管内滴加1滴A溶液,试通过计算说明此时试管内溶液呈现的颜色 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com