
| A、NaOH溶液 | B、铁粉 |
| C、KSCN溶液 | D、石蕊溶液 |
科目:高中化学 来源: 题型:
| A、通过向明矾溶液中加入足量的NaOH溶液,来制备Al(OH)3 |
| B、通过加入澄清石灰水,鉴别Na2CO3溶液和NaHCO3溶液 |
| C、可以通焰色反应的颜色不同来区别FeCl3溶液和FeCl2溶液 |
| D、只需加入足量的NaOH溶液,再过滤,就能除去Fe2O3中的Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
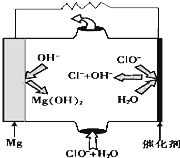 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:| 1 |
| 2 |
| 1 |
| 2 |
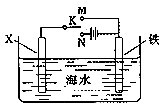
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时,电子从正极流向电源的负极 | |||
| B、放电时,Li+向负极移动 | |||
C、该电池的总反应为LiNiO2+6C
| |||
| D、充电时,阳极发生的电极反应为Li1-xNiO2+xLi++x e-═LiNiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe+HCl |
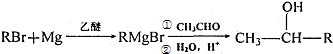
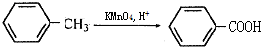
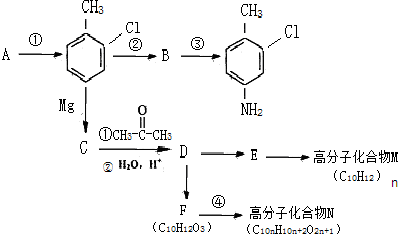
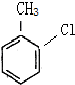 这一途径外,另一途径生成的中间产物的结构简式为
这一途径外,另一途径生成的中间产物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com