
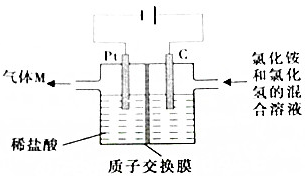
 常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )
常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )| A. | 每生产1molNCl3,理论上有4molH+经质子交换膜有右侧向左侧迁移 | |
| B. | 可用湿润的淀粉纸质检验气体M | |
| C. | 石墨极的电极反应式为NH4++3Cl--6e-=NCl3+4H+ | |
| D. | 电解过程中,质子交换膜右侧溶液的pH会减小 |
分析 根据图示信息知道:石墨电极是阳极,该电极上发生失电子的氧化反应NH4++3Cl--6e-=NCl3+4H+,在阴极上是氢离子得电子的还原反应,电极反应式为:2H++2e-=H2↑,电解过程中,阳离子可以经过质子交换膜移向阴极,但是阴离子不能经过交换膜,根据电子守恒以及电极反应式进行计算回答.
解答 解:A、根据图示信息知道:石墨电极是阳极,该电极上发生失电子的氧化反应NH4++3Cl--6e-=NCl3+4H+,每生产1molNCl3,理论上有6molH+经质子交换膜有右侧向左侧迁移,故A错误;
B、Pt是阴极,在阴极上是氢离子得电子的还原反应,电极反应式为:2H++2e-=H2↑,不可用湿润的淀粉纸质检验氢气,故B错误;
C、石墨电极是阳极,该电极上发生失电子的氧化反应NH4++3Cl--6e-=NCl3+4H+,故C正确;
D、电解过程中,质子交换膜右侧溶液中发生反应:NH4++3Cl--6e-=NCl3+4H+,但是产生的氢离子会移向阴极Pt电极,右侧溶液的pH几乎不变,故D错误.
故选C.
点评 本题考查学生电解池的工作原理以及应用知识,注意电极反应式的书写和电子守恒的计算是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:B>A>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:D ->C 2->B +>A 2+ | D. | 离子的还原性:D ->C 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C与浓HNO3反应 | B. | Cu与浓HNO3反应 | C. | Cu与稀HNO3反应 | D. | Mg(OH)2与HNO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
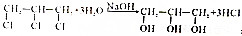 一个碳上连有两个烃基不隐定,容易失去一份水,试回答下列问题:
一个碳上连有两个烃基不隐定,容易失去一份水,试回答下列问题:

 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +2NaCl+2H2O
+2NaCl+2H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.6gHCOOH和C2H5OH的混合物的分子总数为0.1NA | |
| B. | 标准状况下,11.2LNO和O2的混合气体含有的原子总数为1.5NA | |
| C. | 2L0.5mol/L的AlCl3溶液中,含有离子总数为4NA | |
| D. | 常温下,56gFe与足量的浓硝酸反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合成过程是化学变化 | B. | 该元素在第七周期ⅤⅡA族 | ||
| C. | 该元素是非金属性比较强的元素 | D. | 该元素形成的氢化物比较稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 946kJ/mol | B. | 896kJ/mol | C. | 649kJ/mol | D. | 431kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com