
【题目】我国宋代沈括在《梦溪笔谈》中记载:信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。熬胆矾铁釜,久之亦化为铜”。某化学兴趣小组为探究胆矾(![]() )的热分解产物,设计如图所示装置进行实验:
)的热分解产物,设计如图所示装置进行实验:

已知:![]() 的熔点为16.8℃,沸点为46.8℃;
的熔点为16.8℃,沸点为46.8℃;![]() 的熔点为-72℃,沸点为-10℃.
的熔点为-72℃,沸点为-10℃.
请回答下列问题:
(1)仪器a的名称是____,a中的棒香能复燃,说明热分解产物含有_____(填化学式)。
(2)A中固体由蓝色变为黑色,B中的现象是____。
(3)C中冰水的作用是_____。
(4)D中品红溶液褪色,E中有![]() 、
、![]() 生成,写出E中生成
生成,写出E中生成![]() 的总的离子方程式:____。
的总的离子方程式:____。
(5)若生成![]() 和
和![]() 的物质的量之比为1:1,则胆矾热分解的化学方程式为_____。
的物质的量之比为1:1,则胆矾热分解的化学方程式为_____。
(6)小组同学用滴定法测定某胆矾样品中![]() 的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(
的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(![]() )标准溶液滴定至終点,平均消耗EDTA溶液VmL(滴定反应:
)标准溶液滴定至終点,平均消耗EDTA溶液VmL(滴定反应:![]() )。
)。
①样品中![]() 的质量分数为____%(用含m、V的代数式表示)。
的质量分数为____%(用含m、V的代数式表示)。
②下列操作会导致![]() 含量的测定结果偏高的是____(填选项字母)。
含量的测定结果偏高的是____(填选项字母)。
a.未润洗锥形瓶
b.滴定终点时仰视读数
c.滴定终点时滴定管尖嘴中有气泡
【答案】(球形)干燥管 ![]() 固体由白色变为蓝色 防止
固体由白色变为蓝色 防止![]() 挥发(其他合理答案也给分)
挥发(其他合理答案也给分) ![]()
![]()
![]() b
b
【解析】
该题围绕硫酸铜受热分解产物的成分开展实验探究。从实验现象B中的白色![]() 粉末变为蓝色,品红溶液褪色,棒香能复燃等现象可推测出硫酸铜受热分解会产生水蒸气、
粉末变为蓝色,品红溶液褪色,棒香能复燃等现象可推测出硫酸铜受热分解会产生水蒸气、![]() 、
、![]() 。利用题目所给信息,反应生成
。利用题目所给信息,反应生成![]() 和
和![]() 的物质的量之比为1:1,则胆矾热分解的化学方程式为
的物质的量之比为1:1,则胆矾热分解的化学方程式为![]() ,以此作答。
,以此作答。
(1).仪器a的名称是球形干燥管,也可称为干燥管;在a中,棒香能复燃,说明反应中产生了助燃性的气体氧气,故答案应为(球形)干燥管、![]() ;
;
(2). A中固体由蓝色变为黑色,说明胆矾发生了分解,产生了![]() 和水等。故B中的白色
和水等。故B中的白色![]() 粉末因吸水变为蓝色,故答案应为固体由白色变为蓝色;
粉末因吸水变为蓝色,故答案应为固体由白色变为蓝色;
(3). 由题目所给信息可知,![]() 的熔点为16.8℃,沸点为46.8℃,所以C中冰水的作用是为了使
的熔点为16.8℃,沸点为46.8℃,所以C中冰水的作用是为了使![]() 凝结,防止其挥发,影响对
凝结,防止其挥发,影响对![]() 的检验,故答案应为防止
的检验,故答案应为防止![]() 挥发;
挥发;
(4). D中品红溶液褪色,证明气体中存![]() ,故在E中为NaOH与
,故在E中为NaOH与![]() 反应生成
反应生成![]() ,后
,后![]() 被氧气氧化为
被氧气氧化为![]() ,该反应总的离子方程式为:
,该反应总的离子方程式为:![]() ,故答案应为
,故答案应为![]() ;
;
(5). 在反应中当生成1mol![]() 时转移2mol电子,则应有0.5mol
时转移2mol电子,则应有0.5mol![]() 生成,根据题目中生成
生成,根据题目中生成![]() 和
和![]() 的物质的量之比为1:1,则胆矾热分解的化学方程式为
的物质的量之比为1:1,则胆矾热分解的化学方程式为![]() ,故答案应为
,故答案应为![]() ;
;
(6). ①设胆矾样品中![]() 的质量为x克,所以所取待测液中含有的铜离子的物质的量可表示为
的质量为x克,所以所取待测液中含有的铜离子的物质的量可表示为![]() 。由滴定反应原理,可建立如下关系:
。由滴定反应原理,可建立如下关系:
![]()
![]()
![]()
列算式:![]() =
=![]() ,x=0.08V g;则样品中
,x=0.08V g;则样品中![]() 的质量分数为
的质量分数为![]() %;
%;
② a.由于待测液中溶质的量由滴定管控制,故未润洗锥形瓶,对滴定实验结果不产生影响;
b.滴定终点时仰视读数,则使读得标准液的消耗体积偏大,由![]() 可知滴定结果偏高;
可知滴定结果偏高;
c.滴定终点时滴定管尖嘴中有气泡,则使读得标准液的消耗体积比实际消耗的偏小,由![]() 可知滴定结果偏低;
可知滴定结果偏低;
所以导致![]() 含量的测定结果偏高的是b。
含量的测定结果偏高的是b。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】改变0.1mol/L的二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示![]() 。下列叙述正确的是
。下列叙述正确的是
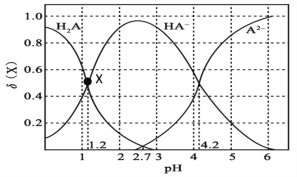
A. Ka2(H2A)的数量级为10- 4
B. 0.1mol/L的NaHA溶液,pH=2.7
C. 向pH=0.5的溶液中逐滴加入强碱至pH=2.7的过程中,每滴一滴强碱,在X点时溶液pH变化最大
D. 0.1mol/LNa2A溶液的pH=8.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知G、Q、X、Y、Z均为含氯元素的化合物,我们不了解它们的化学式,但它们在一定条件下有下列转化关系(未配平,且四个反应均为氧化还原反应):
①G→Q+NaCl ②Q+H2O![]() X+H2↑ ③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
X+H2↑ ③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
A. G、Y、Q、Z、XB. X、Z、Q、G、Y
C. X、Z、Q、Y、GD. G、Q、Y、Z、X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 用FeS去除废水中的Hg2+:Hg2+ + S2- === HgS↓
C. AlCl3溶液与Na2S溶液混合生成沉淀::2 Al3++3S2-==Al2S3↓
D. NH4Cl溶于D2O中显酸性:NH4++D2O![]() NH3·HDO+D+
NH3·HDO+D+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,Z与W同周期且相邻,W原子的最外层电子数与最内层电子数相等;X、Y的单质是空气中的主要成分,在放电或高温作用下化合成无色气体。下列说法正确的是
A. X和Y的单质均不存在同素异形体
B. 简单离子半径:W>X>Z>Y
C. 化合物![]() 溶于水生成碱性气体
溶于水生成碱性气体
D. 工业上常用电解熔融W的氧化物的方法制备W的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=lgc(M),p(CO32)=lgc(CO32)。已知ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是

A. 线a表示ACO3的溶解平衡曲线
B. 该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀
C. 向0.1L 1mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6g时,B2+离子恰好沉淀完全(B2+离子为10—5mol/L时认为沉淀完全)
D. ACO3的Ksp=10—4.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据原电池原理,回答下列问题:
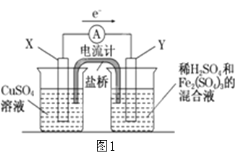
(1)图1是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料是________(填化学名称);电极Y的材料是__________(填化学名称)。
②Y电极发生的电极反应式为:______________。
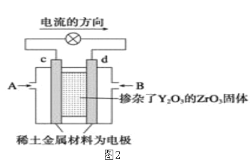
(2)图2是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e―→2O2-)。
①c电极为______________极。(填“正”或“负”)
②d电极上的电极反应式为___________________________。
③如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为______________(用NA表示),需要消耗标准状况下氧气的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
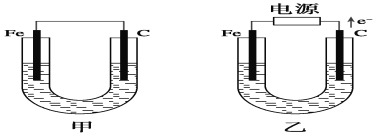
(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是__________________________________。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式_______________________________。
②甲池中碳极上电极反应式是____________________________,乙池碳极上电极反应属于______________(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为________________________________________。
④若乙池转移0.02 mol e-后停止实验,池中电解质溶液体积是200 mL,则溶液混合均匀后的c(OH—)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com