
【题目】向含0.2molNaOH和0.1molBa(OH)2的溶液中持续稳定地通入6.72L(已换算成标准状况)CO2气体。下列表示溶液中离子的物质的量与通入CO2的体积关系的图象中,符合题意的是(气体的溶解和离子的水解都忽略不计)( )
A.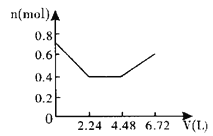
B.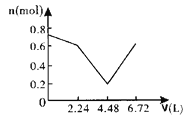
C.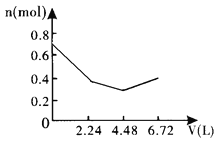
D.
【答案】C
【解析】
n(CO2)=6.72L÷22.4L/mol=0.3mol,通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓+H2O,0.1molBa(OH)2完全反应消耗0.1molCO2,剩余0.2molOH-,生成0.1molBaCO3.然后发生2OH-+CO2=CO32-+H2O,消耗0.1molCO2,生成0.1molCO32-.上述两阶段共消耗0.2molCO2,剩余0.1molCO2,再发生CO32-+CO2+H2O=2HCO3-,消耗0.1molCO2,至此CO2完全消耗,不再发生BaCO3+CO2+H2O=Ba2++2HCO3-反应,最后溶液中溶质为NaHCO3,据此计算解答。
含有0.2mol NaOH和0.1mol Ba(OH)2的溶液中,Na+为0.2mol、Ba2+为0.1mol、OH-为0.2mol+0.1mol×2=0.4mol,离子总的物质的量为:0.2mol+0.1mol+0.4mol=0.7mol。n(CO2)=6.72L÷22.4L/mol=0.3mol。
相当于首先发生:Ba2++2OH-+CO2=BaCO3↓+H2O,该阶段0.1molBa(OH)2完全反应消耗0.1molCO2,体积为2.24L,离子物质的量减少0.3mol,溶液中离子物质的量为0.7mol-0.3mol=0.4mol,其中含有0.2molOH-,生成0.1molBaCO3沉淀。
然后发生2OH-+CO2=CO32-+H2O,0.2molOH-完全反应消耗0.1molCO2,体积为2.24L,该阶段离子物质的量减少0.1mol,溶液中剩余离子物质的量为0.4mol-0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32-。
再发生CO32-+CO2+H2O=2HCO3-,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大0.1mol,溶液中离子为0.4mol,至此CO2完全消耗,不再发生BaCO3+CO2+H2O=Ba2++2HCO3-反应,最后溶液中溶质为NaHCO3,故图象C符合。
故选:C。


科目:高中化学 来源: 题型:
【题目】回答下列填空:
(1)有下列分子或离子:①CS2,②PCl3,③H2S,④CH2O,⑤H3O+,⑥NH4+,⑦BF3,⑧SO2。粒子的立体构型为直线形的有________(填序号,下同);粒子的立体构型为V形的有________;粒子的立体构型为平面三角形的有________;粒子的立体构型为三角锥形的有____;粒子的立体构型为正四面体形的有____。
(2)俗称光气的氯代甲酰氯分子(COCl2)为平面三角形,但C—Cl键与C=O键之间的夹角为124.3°;C—Cl键与C—Cl键之间的夹角为111.4°,解释其原因:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJmol-1,
C(s)+CO2(g)=2CO(g) △H2=+172.5kJmol-1
则CO还原Fe2O3(s)的热化学方程式为____________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
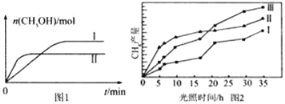
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI______KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为____________。
(4)利用光能和光催化剂,可将CO2和H2(g)转化为CH4和O2,紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为_____________(填序号)
(5)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
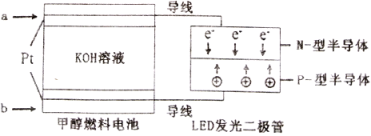
请写出加入(通入)b物质一极的电极反应式________________;每消耗6.4g甲醇转移的电子数为_______________。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将amol/L的醋酸与bmol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
A. 密闭容器中氨气的体积分数不变
B. 1 mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g) + B2(g)=2AB(g) 的能量变化如图所示,下列叙述中正确的是( )
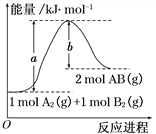
A.每生成2mol AB(g) 共吸收b kJ热量
B.该反应热ΔH = +(a-b) kJ·mol-1
C.反应物的总能量大于生成物的总能量
D.断裂1 mol A—A键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1molA和3molB投入2L密闭容器中发生反应A(g)+3B(g)2C(g)+D(s),2min后,测得C的浓度为0.2mol/L,则下列说法正确的是
A.v(D)=0.05mol/(Lmin) B.3v(B)=2v(C)
C.v(B)=0.15mol/(Lmin) D.A的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
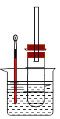
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是_______________________________。
(2)观察到_________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是_________________________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是______________________,检验的方法是_____________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 温度控制在500℃有利于合成氨反应
B. 用排饱和食盐水法收集Cl2
C. 打开碳酸饮料会有大量气泡冒出
D. 工业制取金属钾Na(l)+KCl(l) ![]() NaCl(l)+K(g)选取适宜的温度,使钾变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使钾变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 天然气、水煤气、液化石油气均是生活中常用的燃料,它们的主要成分都是化合物
B. “中国天眼”的“眼眶”是钢铁结成的圈梁,属于金属材料
C. 制玻璃和水泥都要用到石灰石原料
D. 1996年人工合成了第112号元素鎶(Cn),盛放鎶的容器上应该贴的标签是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com