
| A. | 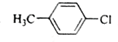 | B. | 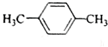 | C. |  | D. | 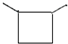 |
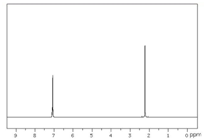
分析 由图可知,核磁共振氢谱有2个吸收峰,面积比约为2:3,故有机物分子中有2种H原子,原子个数比为2:3,结合等效氢判断,等效氢判断:
等效氢判断:
①同一碳原子上的氢原子是等效的,
②同一碳原子上所连接甲基上的氢原子是等效的,
③处于同一对称位置的碳原子上的氢原子是等效的,注意H原子数目之比等于对应峰的面积之比.
解答 解:A. 甲基上1种H原子、苯环上有2种H原子,故核磁共振氢谱中有3个峰,故A错误;
甲基上1种H原子、苯环上有2种H原子,故核磁共振氢谱中有3个峰,故A错误;
B. 甲基上1种H原子、苯环上有1种H原子,故核磁共振氢谱中有2个峰,原子个数比为6:4=3:2,故B正确;
甲基上1种H原子、苯环上有1种H原子,故核磁共振氢谱中有2个峰,原子个数比为6:4=3:2,故B正确;
C. 有2种H原子,故核磁共振氢谱中有2个峰原子个数比为2:6=1:3,故C错误;
有2种H原子,故核磁共振氢谱中有2个峰原子个数比为2:6=1:3,故C错误;
D. 有3种H原子,故核磁共振氢谱中有3个峰原子,故D错误.
有3种H原子,故核磁共振氢谱中有3个峰原子,故D错误.
故选B.
点评 本题考查核磁共振氢谱读图,难度较小,清楚核磁共振氢谱中有几个峰,说明分子中有几种H原子,其面积之比为对应的各种H原子个数之比.


 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:解答题
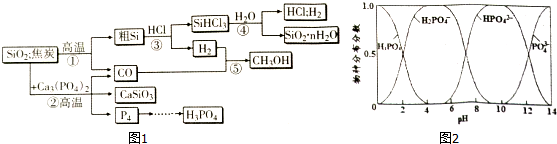
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钠(固体) | B. | 水 | C. | 硫酸钾溶液 | D. | 浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入酸性高锰酸钾溶液 | |
| B. | 氯气用足量氢氧化钠溶液吸收 | |
| C. | 铁粉投入硫酸铜溶液 | |
| D. | 往淀粉和碘化钾的混合溶液中滴加适量的氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
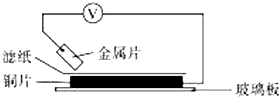 将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表.已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )
将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表.已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | +0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
| A. | 在四种金属中C的还原性最弱 | |
| B. | 金属B能从硫酸铜溶液中置换出铜 | |
| C. | AD若形成原电池时A为正极 | |
| D. | AB形成合金时,将该合金露置在空气中,A先被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )
.乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )| A. | 与CH3OH加成生成CH3CH2COOH | B. | 与H2O加成生成CH3COOH | ||
| C. | 与CH3COOH加成生成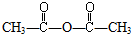 | D. | 与HCl加成生成CH3COCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
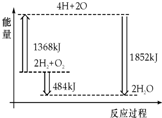
| A. | H2(g)和O2(g)反应生成H2O(g ),这是吸热反应 | |
| B. | 2 mol H2和1 mol O2转化为4 mol H、2 mol O原子的过程中放出热量 | |
| C. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O( g),共放出484 kJ能量 | |
| D. | 4 mol H、2 mol O生成2 mol H2O(g),共放出484 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
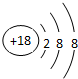
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃钢 | B. | 陶瓷 | C. | 二氧化硅 | D. | 聚乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com