
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 电解NaClO3溶液时阳极反应式为ClO3-+H2O-2e-=C1O4-+2H+
D. 该流程中可循环利用的物质是NH4Cl
【答案】D
【解析】
电解饱和食盐水,生成了NaClO3,再电解得到NaClO4;NaClO4提纯除杂,再和NH4Cl反应,得到高氯酸铵晶体。
A. NH4ClO4由ClO4-和NH4+组成,属于离子化合物,A项正确;
B.NaClO4和NH4Cl能够生成NH4ClO4粗品,铵盐和钠盐都是溶于水的,能够得到晶体,说明NH4ClO4溶解度比其他物质小,,B项正确;
C. 根据流程图,电解NaClO3生成NaClO4,阳极失去电子,1molClO3-失去2mol电子生成1molClO4-,结合电荷守恒和原子守恒,电极反应式为ClO3--2e-+H2O=ClO4-+2H+,C项正确;
D. NaClO4和NH4Cl反应生成NH4ClO4和NaCl,循环利用的是NaCl,而不是NH4Cl, D项错误;
本题答案选D。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO和2.24L O2混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O=HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼![]() 最重要的用途是作为铁合金的添加剂,用CO还原
最重要的用途是作为铁合金的添加剂,用CO还原![]() 制备单质Mo的装置如图所示
制备单质Mo的装置如图所示![]() 尾气处理装置已省略
尾气处理装置已省略![]() 下列说法正确的是
下列说法正确的是![]()
![]()

A.装置![]() 中的药品为石灰石粉末
中的药品为石灰石粉末
B.装置![]() 中盛有饱和碳酸氢钠溶液,
中盛有饱和碳酸氢钠溶液,![]() 中盛有澄清石灰水
中盛有澄清石灰水
C.在装置![]() 中生成了钼单质
中生成了钼单质
D.![]() 中溶液变浑浊,说明产生的
中溶液变浑浊,说明产生的![]() 一定是来自
一定是来自![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.2A![]() B+C在某一温度时,达到平衡。
B+C在某一温度时,达到平衡。
(1)若温度升高,平衡向正反应方向移动,则正反应是________反应(填“放热”或“吸热”);
(2)若B为固体,减小压强平衡向逆反应方向移动,则A呈______态;
(3)若A、B、C均为气体,加入催化剂,平衡______移动(填“正向”、“逆向”或“不”)
Ⅱ.在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下列空白。
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下列空白。
(1)用D表示的平均反应速率为____________,A的转化率为____________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度____________(填“增大”、“减少”或“不变”)。
(3)若向原平衡体系再投入1 molA和1 mol B,平衡____________(填“右移、左移或不移”)。
Ⅲ.氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol。
2NH3(g);ΔH=-92.4 kJ/mol。
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是____________,其中表示平衡混合物中NH3的含量最高的一段时间是____________。
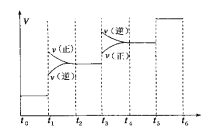
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,室温下向盛有3.0mL NO的试管中缓缓通入1.5mL O2(所有气体的体积均在标准状况下测定)。

试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①__________;
②__________;
③__________。
(2)上述过程中发生反应的化学方程式有__________。
(3)最终试管中剩余的气体是__________,体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料,由A制备聚丙烯酸甲酯(有机玻璃主要成分)和肉桂酸的合成路线(部分反应条件略去)如图所示:
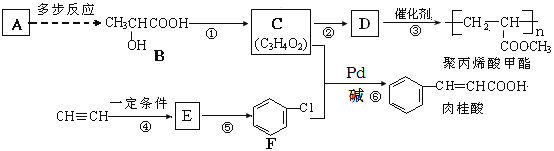
已知:①E的相对分子质量在70~80之间,步骤④的反应类型是加成反应
②![]() +CH2=CH2
+CH2=CH2![]() +HX (X为卤原子,R为取代基)
+HX (X为卤原子,R为取代基)
回答下列问题:
(1)F的名称是________;反应①的反应试剂和反应条件是________;⑥的反应类型是________。
(2)反式肉桂酸的结构简式为_________。
(3)由C制取D的化学方程式为_________。
(4)肉桂酸的同分异构体中能同时满足下列条件的共有_______种(不考虑立体异构);
①能与FeCl3溶液发生显色反应;
②能使溴的四氯化碳溶液褪色;
③能发生银镜反应。
其中苯环上只有两个取代基,核磁共振氢谱为6组峰、且峰面积比为2:2:1:1:1:1的是:________(写结构简式)。
(5)请运用所学知识并结合信息: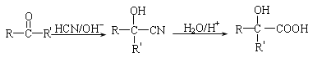 ,设设计由A(C2H4)制备B的合成路线(无机试剂任选):____________。
,设设计由A(C2H4)制备B的合成路线(无机试剂任选):____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组利用以下装置制取并探究氨气的性质。在A装置中发生反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
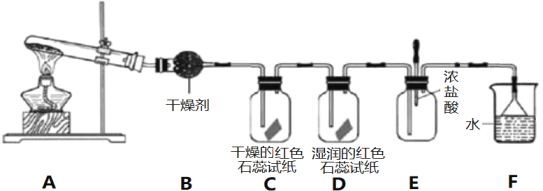
(1)B装置中的干燥剂是_________________(填“碱石灰”或“浓硫酸”)。
(2)C、D装置中试纸颜色会发生变化的是___________(填”C”或“D”)。
(3)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到E装置中的现象是产生_____________(填”白烟”或“白雾”)。
(4)烧杯F中水的作用是________________________。
(5)欲制得标准状况下11.2 LNH3,至少需要Ca(OH)2的质量为____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟实验探究锡及锡的化合物的部分性质。经查阅资料知:Sn的熔点为![]() ;
;![]() 易被氧化,且易水解;
易被氧化,且易水解;![]() 常温下易分解,
常温下易分解,![]() 常温下为无色液体,熔点为
常温下为无色液体,熔点为![]() ,沸点为
,沸点为![]() ,回答下列问题:
,回答下列问题:
(1)该小组用以下流程制备![]() 晶体:
晶体:
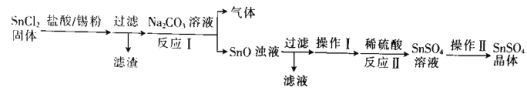
![]() 加入锡粉的作用为______________________________________。
加入锡粉的作用为______________________________________。
![]() 反应Ⅰ的离子方程式为______________________________。
反应Ⅰ的离子方程式为______________________________。
![]() 操作Ⅰ为沉淀的洗涤,请简述如何判断沉淀是否洗涤干净:_____________________。
操作Ⅰ为沉淀的洗涤,请简述如何判断沉淀是否洗涤干净:_____________________。
(2)用熔融的锡与干燥的氯气制备![]() ,实验装置如下:
,实验装置如下:
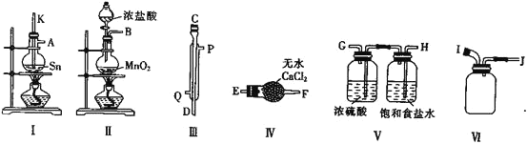
![]() 装置Ⅲ为冷凝管,则水流从__________
装置Ⅲ为冷凝管,则水流从__________![]() 填“Q”或“P”
填“Q”或“P”![]() 口进入。
口进入。
![]() 请用大写英文字母表示的接口按从左到右顺序组装仪器:__________________________。
请用大写英文字母表示的接口按从左到右顺序组装仪器:__________________________。
![]() 整个装置存在的不足之处为_________________________。
整个装置存在的不足之处为_________________________。
(3)该小组通过下列方法测定所用锡粉的纯度:取产品![]() 溶于稀硫酸中,加入过量的
溶于稀硫酸中,加入过量的![]() 溶液,再用
溶液,再用![]() 的
的![]() 溶液滴定
溶液滴定![]() ,消耗
,消耗![]() 溶液
溶液![]() 。已知
。已知![]() ,
,![]() ,
,![]() 。则锡粉的质量分数为
。则锡粉的质量分数为![]() 杂质不参与反应
杂质不参与反应![]() ______________
______________![]() 结果保留三位有效数字
结果保留三位有效数字![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡![]() 熔点
熔点![]() 与
与![]() 反应制备
反应制备![]() ,装置如图。
,装置如图。
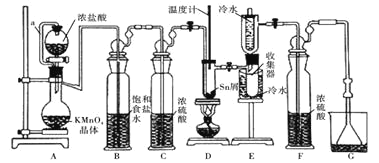
已知:![]() 、
、![]() 有关物理性质:
有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
![]() 极易水解生成
极易水解生成![]() 。回答下列问题:
。回答下列问题:
(1)导管a的作用是____________,装置A中发生反应的离子方程式为____________________。
(2)当观察到装置F液面上方___________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是![]() ________;
________;![]() ______
______
(3)若上述装置中缺少装置![]() 其它均相同
其它均相同![]() ,则D处具支试管中发生的主要副反应化学方程式为_________________________________。
,则D处具支试管中发生的主要副反应化学方程式为_________________________________。
(4)![]() 和锡的反应产物有
和锡的反应产物有和
![]() ,为防止产品中带入过多的
,为防止产品中带入过多的![]() ,可采取的措施是____________________________________________。
,可采取的措施是____________________________________________。
(5)滴定分析产品中2价![]() Ⅱ
Ⅱ![]() 的含量:用分析天平称取
的含量:用分析天平称取![]() 产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用
产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用![]() 的碘标准溶液滴定至终点时消耗
的碘标准溶液滴定至终点时消耗![]() ,则产品中
,则产品中![]() Ⅱ
Ⅱ![]() 的质量分数为___________。
的质量分数为___________。![]() 小数点后保留2位,已知
小数点后保留2位,已知![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com