

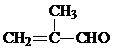 ;J的结构简式为
;J的结构简式为 .
.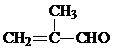 +2[Ag(NH3)2]OH→CH2=C(CH3)COONH4+2Ag↓+3NH3+H2O.
+2[Ag(NH3)2]OH→CH2=C(CH3)COONH4+2Ag↓+3NH3+H2O. +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.分析 据Y的分子式和Y能够与NaOH的水溶液反应生成的J不能被催化氧化,可知J为
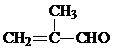
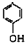 ,E和氢气发生加成反应生成F,则F的结构简式为:
,E和氢气发生加成反应生成F,则F的结构简式为: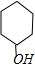 ,F和D发生酯化反应生成X,则X的结构简式为:
,F和D发生酯化反应生成X,则X的结构简式为:
解答 解:(1)据B的结构简式和A的性质判断,A为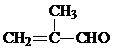

(2)据Y的分子式和Y能够与NaOH的水溶液反应生成的J不能被催化氧化,可知J为
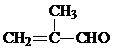
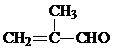

(3)D的结构简式为:(CH3)2CHCOOH,遇浓溴水无明显变化,E的结构简式为: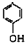 ,遇浓溴水生成白色沉淀,H的结构简式为:CH2=C(CH3)COOH,能够使浓溴水褪色,故答案为:浓溴水;
,遇浓溴水生成白色沉淀,H的结构简式为:CH2=C(CH3)COOH,能够使浓溴水褪色,故答案为:浓溴水;
(4)①B的结构简式为:(CH3)2CHCH2OH,B被氧气氧化生成醛C,C的结构简式为:(CH3)2CHCHO,反应的化学方程式为2(CH3)2CHCH2OH+O2$→_{△}^{Cu}$2(CH3)2CHCHO+2H2O,故答案为:2(CH3)2CHCH2OH+O2$→_{△}^{Cu}$2(CH3)2CHCHO+2H2O;
②A为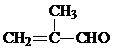
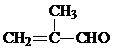
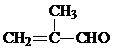
③D的结构简式为:(CH3)2CHCOOH,F的结构简式为: ,D与F发生酯化反应的化学方程式为
,D与F发生酯化反应的化学方程式为





(5)H的结构简式为:CH2=C(CH3)COOH,其同分异构体满足条件,②在酸性条件下能够水解,可知其为酯,①链状化合物的可能有CH2=C(CH3)OOCH、CH2=CHOOCCH3、CH2=CCH2OOCH、CH2=CHCOOCH3,CH3CH=CHOOCH,共5种,故答案为:5.
点评 本题考查了有机物的推断,明确有机物的官能团性质是解本题关键,难点是方程式的书写和同分异构体的书写,要注意有机物的断键和成键位置,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂可加快SO2转化为SO3的速率 | |
| B. | H2、I2、HI平衡混合气加压后颜色变深 | |
| C. | 装有NO2、N2O4平衡混合气的玻璃球在冷水中气体颜色变浅 | |
| D. | SO2通入氯水,氯水的颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
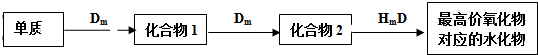
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下)另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g.
今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下)另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
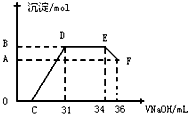 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某高聚物的单体A(C11H12O2)可发生如图变化:
某高聚物的单体A(C11H12O2)可发生如图变化: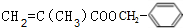 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,含有离子键和共价键(填化学键类型),属于离子化合物 (填“离子化合物”或“共价化合物”)
,含有离子键和共价键(填化学键类型),属于离子化合物 (填“离子化合物”或“共价化合物”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 假设方案编号 | 相应现象 |
| 假设1 | 品红试液不褪色,澄清石灰水变浑浊 |
| 假设2 | 品红试液褪色,澄清石灰水不变浑浊 |
| 假设3 | 品红试液褪色,酸性高锰酸钾溶液颜色变浅(或不褪色),澄清石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定溶液的pH时,先将pH试纸用蒸馏水润湿,再测量 | |
| B. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,先向烧瓶中加入几片碎瓷片,再加热 | |
| C. | 分液时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com