
向含有下列离子的溶液中分别加入烧碱固体(溶液体积变化可忽略),能引起离子浓度减小的是( )
|
| A. | CO32﹣ | B. | Cl﹣ | C. | OH﹣ | D. | Cu2+ |
科目:高中化学 来源: 题型:
甲、乙两容器中均进行反应:N2+3H2⇌2NH3,在相同时间内,甲容器中断裂1molN≡N键且同时形成3molH﹣H键,乙容器中断裂0.5molN≡N键且同时断裂3molN﹣H键,下列说法正确的是( )
|
| A. | 甲容器中的反应速率一定大于乙容器中的反应速率 |
|
| B. | 甲容器中的反应速率可能小于乙容器中的反应速率 |
|
| C. | 无法判断两容器中的上述反应是否都达到了平衡状态 |
|
| D. | 上述两容器中的反应一定是在相同温度和相同压强下进行的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中进行反应:
2SO2(g)+O2(g)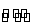 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达平衡时,可能存在的数据是( )
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO2、SO3均为0.15 mol·L-1
D.SO3为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( )
|
| A. | 容量瓶事先未烘干 |
|
| B. | 定容时俯视观察液面 |
|
| C. | 未用蒸馏水洗涤烧杯 |
|
| D. | 定容后,摇匀时有少量液体流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 1mol任何气体的体积一定是22.4L |
|
| B. | 标准状况下,22.4L任何气体所含分子数都约为6.02×1023个 |
|
| C. | 在标准状况下,体积为22.4L的物质都是1mol |
|
| D. | 在非标准状况下,1mol任何气体的体积不可能是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式是:2NaIO3+5NaHSO3=3NaHSO4+2NaSO4+I2+H2O
(1)反应中 元素被氧化, 是氧化剂.
(2)反应产物中,氧化产物与还原产物的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
乳酸分子式为C3H6O3,在一定的条件下可发生许多化学反应,下图是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物.(已知﹣OH,﹣COOH等为亲水基团,F常做内燃机的抗冻剂)请回答相关问题:
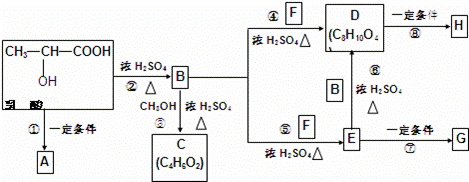
(1)推断结构简式,C: ;F: .
(2)B中所含的官能团有 ;反应③的反应类型是 .
(3)反应①的化学方程式为 .
(4)作为隐形眼镜的制作材料,对其性能的要求除应具有良好的光学性能外,还应具有良好的透气性和亲水性.一般采用E的聚合物G而不是D的聚合物H来制作隐形眼镜,其主要理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过。电池充、放电的化学方程式为2Na2S2+NaBr3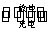 Na2S4+3NaBr
Na2S4+3NaBr
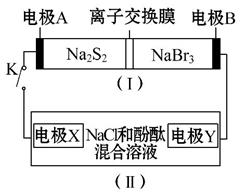
当闭合K时,X极附近溶液先变红色。下列说法中正确的是 ( )
A.装置(Ⅰ)中Na+从右到左通过离子交换膜
B.A电极的电极反应式为NaBr3+2Na++2e-====3NaBr
C.X电极的电极反应式为2Cl--2e-====Cl2↑
D.每有0.1 mol Na+通过离子交换膜,X电极上就放出标准状况下的气体1.12 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com