
(16分)在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+ O2 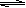 2SO3
2SO3
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。SO2转化为SO3的热化学方程式是 。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速率 。该反应K值将 。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。
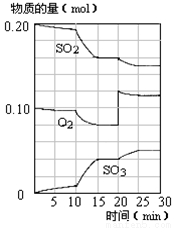
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是 (填写编号)。
a.增加SO3的物质的量 b.增大容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是 。
(1)SO2(g)+ 1/2O2(g) = SO3(g) △H = -85kJ/mol(3分)
(2)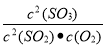 (2分) (3)减小 ,增大。(4分)
(2分) (3)减小 ,增大。(4分)
(4)b.d.(2分) (5)d(2分) (6)20%(3分)
【解析】
试题分析:(1)在450℃条件下,SO3为气态,再根据64g SO2完全转化为SO3会放出85kJ热量,可知该反应的热化学方程式为:SO2(g)+1/2O2(g)=SO3(g)△H=-85kJ/mol;
(2)2SO2(g)+O2(g) 2SO3(g),依据化学平衡常数概念是平衡状态生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积得到,平衡常数为:K=
2SO3(g),依据化学平衡常数概念是平衡状态生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积得到,平衡常数为:K=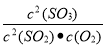 ;
;
(3)降低温度反应速率减小,该反应正反应为放热反应,降低温度平衡向正反应方向移动,平衡常数k增大;
(4)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态,a和c错误,b和d 正确,故答案为:bd;
(5)由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变,a、10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故a错误;b、增大容器体积,减小压强,反应速率降低,故b不正确;c、降低温度反应速率降低,故c错误;d、加了催化剂,增大反应速率,故d正确;故答案为:d;
(6)由图可知,起始时SO2的物质的量为0.2mol,平衡时SO2的物质的量为0.16mol,则SO2的转化率=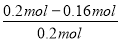 ×100%=20%。
×100%=20%。
考点:考查热化学方程式、平衡常数、平衡移动的影响因素、化学平衡图象、转化率等


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
| A、分子中3个碳原子在同一直线上 | B、分子中所有原子在同一平面上 | C、与氯化氢加成只生成一种产物 | D、能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铁溶液中加入还原性铁粉 | B、硫酸铁溶液中滴加硫氰化钾溶液 | C、碘水中滴加淀粉碘化钾溶液 | D、碳酸氢钠溶液中滴加稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、神舟10号飞船所用太阳能电池板的材料是单晶硅 | B、用于制作集成电路板的酚醛树脂是天然高分子化合物 | C、工业上获得大量乙烯、丙烯、丁二烯的方法是石油裂化 | D、日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
下列分离、提纯、鉴别物质的方法正确的是
A. 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
B. 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C. 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D. 用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:填空题
(16分)已知合成氨的反应为3H2(g)+N2(g) 2NH3(g) △H<0,在某密闭容器中测得实验数据及数据处理如下表。
2NH3(g) △H<0,在某密闭容器中测得实验数据及数据处理如下表。
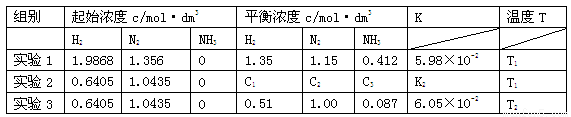
(1)下列说法可以说明合成氨反应达到平衡的是
A.恒容时,整个容器内密度不变
B.恒压时,容器内平均相对分子质量不变
C.1 mol N≡N键断裂的同时,有3mol H-H键断裂
(2)当升高温度时,平衡向 方向移动(填“正”或“逆”),请画出在t2时刻升温后的v-t图,并作出必要的标注。

(3)表中实验2的K2= ,温度T1、T2的大小关系是 ,你判断的理由是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2能使溴水褪色 |
B | 铁比铜活泼 | 铜容器可以盛放浓硝酸 |
C | 铜绿的主成分是碱式碳酸铜 | 可用稀盐酸除去铜器表面的铜绿 |
D | 铜表面易形成致密的氧化膜 | 铜板上的铁钉在潮湿空气中不易生锈 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:实验题
(16分)白钨矿的主要成分是CaWO4 ,含有二氧化硅、氧化铁等杂质,工业生产钨流程如下:

(完全沉淀离子的pH值:SiO32-为8,WO42-为5)
(1)白钨矿反应前需要进行粉碎,其目的是____________。CaWO4与纯碱发生的化学反应方程式是_______________________________。
(2)滤渣A的主要成分是(写化学式)_____________,滤渣B的化学式是__________。
(3)调节pH可选用的试剂是:__________。
A.氨水 B.氢氧化钠溶液 C.盐酸
(4)母液中加入盐酸的离子方程式为________________________________________。
(5)白钨矿中CaWO4的质量分数为30%,576千克白钨矿理论上最多能生产钨_____kg。(已知钨酸钙的相对分子质量为288)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com