
| A.①②③④⑤ | B.①②③⑤ | C.①②③④ | D.①②③ |
科目:高中化学 来源:不详 题型:填空题
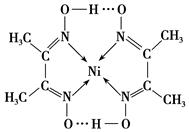
| A.氢键 | B.离子键 | C.共价键 | D.金属键 E.配位键 |
 ②
② 、③
、③ 、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________ 。
、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________ 。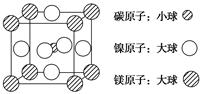
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔点1070℃,易溶于水,水溶液能导电 |
| B.熔点是10.31℃,液体不导电,水溶液能导电 |
| C.熔点97.81℃,质软,能导电,密度是0.97g/cm3 |
| D.熔点781℃,熔化时能导电,水溶液也能导电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
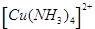 中的配位键 。
中的配位键 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.久置于空气中会变成白色 |
| B.具有强氧化性 |
| C.晶体中存在离子键与非极性键 |
| D.是一种碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.[Fe(CN)6]3->[Fe(SCN)6] 3- | B.[HgCl4] 2-> [HgF4] 2- |
| C.[AlF6] 3->[AlBr6] 3- | D.[Cu(NH3) 4]2+>[Zn(NH3) 4]2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com