
溶液、胶体和浊液这三种分散系的根本区别是 ( )
A.是否大量分子或离子的集合体 B.分散质粒子直径的大小
C.是否能通过滤纸或半透膜 D.是否均一、稳定、透明
科目:高中化学 来源: 题型:
下列各组中的反应,属于同一反应类型的是 ( )
A.由溴丙烷水解制丙醇,由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯,由甲苯氧化制苯甲酸
C.由氯乙烷制乙烯,由丙烯与溴反应制1,2二溴丙烷
D.由乙酸和乙醇制乙酸乙酯,由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
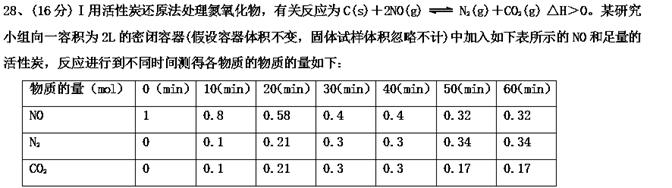 (1)10 min~20 min以v(CO2)表示的反应速率为________ mol·L-1·s-1。
(1)10 min~20 min以v(CO2)表示的反应速率为________ mol·L-1·s-1。
(2) 在10min和40min这两个时间分别改变了一个条件,则10min时改变的条件可能是________(填选项字母)。
A.升高温度 B.降低温度 C.加入催化剂
D.增加N2的浓度 E.减小NO的浓度 F.减小CO2的浓度
(3) 一定温度下,随着NO的起始浓度增大,则NO的平衡转化率________(填“增大”、“不变”或“减小”)。
Ⅱ臭氧是一种在生产生活中有着广泛运用的化学物质,可以用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。目前常用的人工制备臭氧的方法有:电晕放电法、电化学法、紫外线法等。其中电化学法因其设备简易,使用维修简单、安全,生成臭氧成分纯净等特点而得到广泛运用。某课外小组运用下图装置以PbO2做阳极,Pt电极为阴极电解饱和K2SO4溶液制备O3 ,并采用碘量法测定臭氧的产率。(已知电解时在阳极可能有生成O2的副反应发生,碘量法测定的过程中不考虑O2和KI反应 )

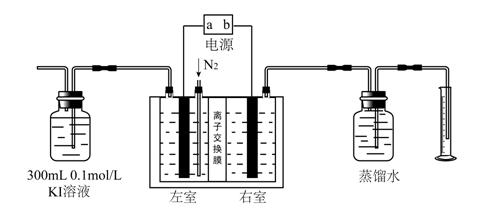
实验过程如下:
①按上图连接好装置,检查气密性后接通电源开始进行反应。
②电解的过程中以1.5L/min的速率鼓入N2 ,使产生的O3能够完全被KI溶液吸收,反应后有O2生成(不考虑该过程中溶液体积变化)。
③电解20 min后,通过量筒测得右室中产生的气体体积为224 ml(已转化为标准状况)。
④将充分吸收了O3的300ml KI溶液取出30.00 ml,加入2滴0.1mol/L的淀粉溶液作指示剂,用0.01mol/L的Na2S2O3溶液进行滴定。测得消耗Na2S2O3溶液的体积为31.00ml。(已知反应的化学方程式为:I2 + 2Na2S2O3 = Na2S4O6 + 2NaI )
(1)右室产生的气体为 (填化学式),写出左室发生的电极反应方程式 。
(2)写出KI溶液吸收O3的化学方程式 。
(3)该实验过程中鼓入N2的速率不能过快,若鼓入太快测定出臭氧的产率将偏 (填“大”或“小”),根据实验所得数据,该装置产生臭氧的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
200 mL 0.3 mol·L-1的K2SO4溶液和100 mL 0.2 mol·L-1的Fe2(SO4)3溶液混合后,若忽略液体混合时体积的变化,则溶液中SO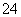 的物质的量浓度为
的物质的量浓度为
A.0.3 mol·L-1 B.0.4 mol·L-1 C.0.45 mol·L-1 D.0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol。求:
(1)原NaOH溶液的质量分数。
(2)所得溶液中Cl-的物质的量。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法是 ( )
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,甲容器中的NH3和乙容器中的CH4所含的原子总数相同,则甲容器与乙容器的体积之比为 ( )
A.1:1 B.2:1 C.3:4 D.5:4
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修3;物质结构与性质](15分)
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题;
(1)b、c、d中第一电离能最大的是________(填元素符号),e的价层电子轨道示意图为________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为______;分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是________;酸根呈三角锥结构的酸是________。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图(a),则e离子的电荷为________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构[如图(b)所示]。
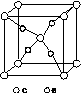
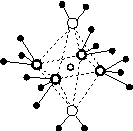
(a) (b)
该化合物中,阴离子为________,阳离子中存在的化学键类型有________;该化合物加热时首先失去的组分是________,判断理由是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为_____________________;Al与NaOH溶液反应的离子方程式为
________________________________________________。
(2)30Si的原子的中子数为_________;SiO2晶体类型为__________________。
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是__________。
(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com