
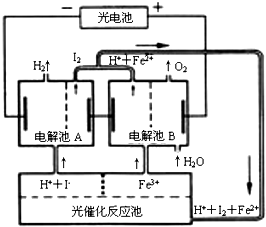
| A. | 外电路中每通过0.2 mol电子,电解池B中就会生成1.12L氧气 | |
| B. | 光催化反应池中离子反应式是:2Fe2++I2$\frac{\underline{\;光照\;}}{\;}$Fe3++2I- | |
| C. | 电解池B中阴极反应式是:Fe3++e-═Fe2+ | |
| D. | 电解池A的阳极反应式是:2I--2e-═I2 |
分析 A.温度和压强未知导致气体摩尔体积未知,所以无法计算气体体积;
B.根据图片知,光电池中亚铁离子、碘反应生成铁离子、碘离子;
C.电解池B中阴极上铁离子得电子发生还原反应;
D.电解池A中阴极上碘离子失电子发生氧化反应.
解答 解:A.温度和压强未知导致气体摩尔体积未知,能根据氧气和电子之间的关系式计算氧气物质的量,但无法计算气体体积,故A错误;
B.根据图片知,光电池中亚铁离子、碘反应生成铁离子、碘离子,离子反应方程式为2Fe2++I2$\frac{\underline{\;光照\;}}{\;}$Fe3++2I-,故B正确;
C.电解池B中阴极上铁离子得电子发生还原反应,电极反应式为Fe3++e-═Fe2+,故C正确;
D.电解池A中阴极上碘离子失电子发生氧化反应,电极反应式为2I--2e-═I2,故D正确;
故选A.
点评 本题考查化学电源新型电池,正确书写各个电极反应式是解本题关键,为高考高频点,熟悉图片中各个电极发生的反应,易错选项A,注意气体摩尔体积适用范围及适用条件.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
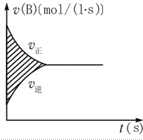
| A. | A浓度的减小量 | B. | B浓度的减小量 | ||
| C. | C物质的量的增加量 | D. | B物质的量的减少量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
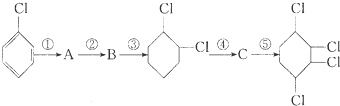
 ,B:
,B: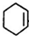 ,C:
,C: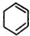 .
.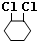 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O、
+2NaCl+2H2O、 +2Cl2→
+2Cl2→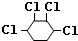 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | Q |
| Fe | H2O(g) | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com