
��2013?�Ĵ�����һ���¶��£�������X������Y ��0.16mol����10L �����ܱ������У�������ӦX��g��+Y��g��?2Z��g����H��0��һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ���������±�������˵������ȷ���ǣ�������
|
| ||
| ��t |
| ||
| 2min |
| 0.122 |
| 0.1��0.1 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� | ���� | ���� |
| ȡ��������Ag+�����Һ���Թ��У�����KSCN��Һ���� | ����Һ��Ѫ��ɫ ����Һ��Ѫ��ɫ |
����Fe3+ |
| ȡ��������Ag+�����Һ���Թ��У����� ��K3[Fe��CN��6]��Һ ��K3[Fe��CN��6]��Һ ���� |
�۲�����ɫ���� �۲�����ɫ���� |
����Fe2+ |
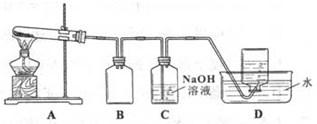
| ʵ���� | ���� | ���� |
| a | ����������ˮ���� | ��ɫ���岻�ܽ� |
| b | ��������ϡ���ᣬ�� | ��ɫ�����ܽ⣬����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
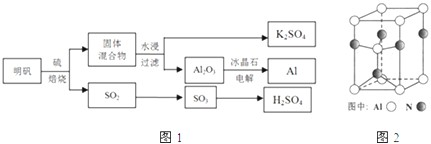
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com