
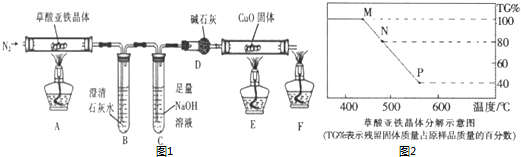
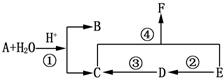
分析 实验时先通一会氮气,其目的是利用氮气排除装置中的空气,避免空气中二氧化碳对实验造成干扰,加热AE,观察到现象,停止加热装置A、E,继续通入N2,其目的是实验结束把生成的产物全部赶到后面的装置充分反应,减少测定误差,最后停止通入氮气,草酸亚铁晶体分解生成的气体进入装置B检验是否生成二氧化碳气体,通过氢氧化钠溶液除去二氧化碳,装置D吸收水蒸气,气体进入装置E,还原氧化铜生成红色铜证明一氧化碳的存在,最后剩余一氧化碳点燃处理,防止污染空气,
(1)F为酒精灯;
(2)利用生成氮气提供惰性环境,避免干扰分解产物的分析和验证,加入药品前,应该进行的实验操作是检查装置气密性检查,实验时先通一会氮气,其目的是利用氮气排除装置中的空气,加热AE,观察到现象,停止加热装置A、E,继续通入N2;
(3)B中是澄清石灰水,生成沉淀证明生成二氧化碳,证明一氧化碳生成可以利用装置E,一氧化碳还原氧化铜反应生成二氧化碳说明;
(4)C中氢氧化钠溶液是吸收二氧化碳,避免干扰一氧化碳的检验;
(5)分解生成物有二氧化碳、一氧化碳,依据氧化还原反应电子转移守恒分析判断;
(6)N点残留固体质量占原样品总质量的百分数位80%,损失20%,FeC2O4.nH2O中结晶水的质量,$\frac{18n}{144+18n}$×100%=20%,n=2,故M→N发生反应是FeC2O4.2H2O加热失去结晶水;由图可知已知图中N时刚好完全失去结晶水,加热至P时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则P固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,即铁原子与氧原子物质的量之比为1:1,应为FeO,N点到P点是FeC2O4分解的反应.
解答 解:(1)仪器图形和作用可知F为酒精灯,故答案为:酒精灯;
(2)实验时先通一会氮气,其目的是利用氮气排除装置中的空气,避免空气中二氧化碳对实验造成干扰,加热AE,观察到现象,停止加热装置A、E,继续通入N2,其目的是实验结束把生成的产物全部赶到后面的装置充分反应,减少测定误差,最后停止通入氮气,实验操作顺序为④①③②⑤⑥,
故答案为:③②⑤⑥;
(3)在实验中观察到B中出现浑浊,说明生成物中有二氧化碳气体,E的硬质玻管内固体变红,说明是一氧化碳还原氧化铜得到金属铜,证明分解生成物中含CO2、CO,
故答案为:CO2、CO;
(4)C中氢氧化钠溶液是吸收二氧化碳,避免干扰一氧化碳的检验,
故答案为:除去二氧化碳气体;
(5)结合(3)可知生成产物中含二氧化碳和一氧化碳,草酸亚铁晶体(FeC2O4•nH2O)分解,其中碳元素化合价+3价变化为+4价和+2价,得到一氧化碳和二氧化碳物质的量之比为1:1,依据氧化还原反应电子守恒可知亚铁离子化合价未发生变化,碳酸亚铁分解生成二氧化碳和氧化亚铁,若只有碳酸亚铁,不能生成二氧化碳,
故答案为:ad;
(6)N点残留固体质量占原样品总质量的百分数位80%,损失20%为结晶水的质量含量,FeC2O4.nH2O中结晶水的质量,$\frac{18n}{144+18n}$×100%=20%,n=2,故M→N发生反应是FeC2O4.2H2O加热失去结晶水;由图可知N加热生成P时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,氧原子物质的量为1mol,即铁原子与氧原子物质的量之比为1:1,应为FeO,依据氧化还原反应电子守恒分析计算,碳元素化合价从+3价变化为+2价和+3价,生成一氧化碳和二氧化碳气体,原子守恒配平写出化学方程式;FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O;
故答案为:FeC2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O.
点评 本题结合草酸亚铁晶体的分解考查了实验方案设计、实验现象分析、实验数据分析、根据化学式的计算等知识点,综合性较强,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 第二周期 | Li | Be | B | C | N | O | F |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | |
| 第三周期 | Na | Mg | Al | Si | P | S | Cl |
| 电负性值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率通常用单位时间内反应物或生成物的质量变化来表示 | |
| B. | 用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 | |
| C. | 反应速率越大,则单位时间内生成物的产量就越大 | |
| D. | 在反应过程中,反应物浓度逐渐变小,所以用反应物表示的化学反应速率为负值 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶 | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| D. | 酸式滴定管尖嘴部分开始实验时有气泡,滴定后无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com