
【题目】H2O2在工业、农业、医药上都有广泛的用途.
(1)H2O2是二元弱酸,写出第一步的电离方程式__,第二步的电离平衡常数表达式Ka2=_________.
(2)许多物质都可以做H2O2分解的催化剂.一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化).下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是________.
①I - ②Fe3+ ③Cu2+ ④Fe2+
(3)H2O2是一种环境友好的强氧化剂.电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+等)制备硫酸镍的一种流程如下:
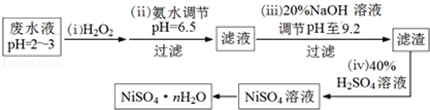
①第(ⅰ)步,加入H2O2反应的离子方程式_________________.
②为测定NiSO4nH2O的组成,进行如下实验:称取2.627g样品,配制成250.00mL溶液.准确量取配制的溶液25.00mL,用0.04000molL﹣1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++H2Y2﹣=NiY2﹣+2H+),消耗EDTA标准溶液25.00mL.则硫酸镍晶体的化学式为__________________.
【答案】 H2O2H++HO2﹣ 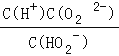 ①④ 2Fe2++H2O2+2H+=2Fe3++2H2O NiSO46H2O
①④ 2Fe2++H2O2+2H+=2Fe3++2H2O NiSO46H2O
【解析】(1)第一步电离,1个H2O2电离出1个H+,电离方程式为:H2O2![]() H++HO2-;第二步电离为:HO2-
H++HO2-;第二步电离为:HO2-![]() O22+H+,所以电离平衡常数Ka2=
O22+H+,所以电离平衡常数Ka2=![]() 。(2)在反应过程中先被氧化,后被还原,说明该物质具有还原性,I、Fe2+具有较强的还原性,故①④正确。(3)①废水中含有Fe2+,具有还原性,被H2O2氧化,离子方程式为:2H++ 2Fe2++ H2O2=2Fe3++2H2O;②根据方程式:Ni2++H2Y2-=NiY2-+2H+,原样品含NiSO4的物质的量为:0.04000mol/L×0.025L×250/25=0.01mol,则该物质的摩尔质量为:2.627g÷0.01mol=262.7g/mol,结晶水的系数为:(262.7-154.7)÷18=6,所以化学式为:NiSO4·6H2O。
。(2)在反应过程中先被氧化,后被还原,说明该物质具有还原性,I、Fe2+具有较强的还原性,故①④正确。(3)①废水中含有Fe2+,具有还原性,被H2O2氧化,离子方程式为:2H++ 2Fe2++ H2O2=2Fe3++2H2O;②根据方程式:Ni2++H2Y2-=NiY2-+2H+,原样品含NiSO4的物质的量为:0.04000mol/L×0.025L×250/25=0.01mol,则该物质的摩尔质量为:2.627g÷0.01mol=262.7g/mol,结晶水的系数为:(262.7-154.7)÷18=6,所以化学式为:NiSO4·6H2O。


科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H2)是基本有机化工原料.由A制备聚乙烯醇缩丁醛和顺式聚异戊二烯的合成路线(部分反应条件略去)如图所示:
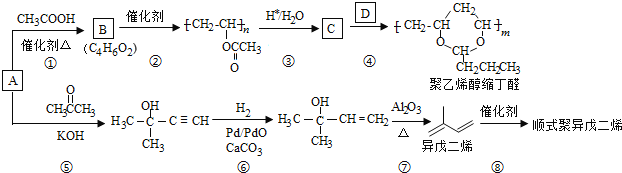
回答下列问题:
(1)A的名称是____________,B含有的官能团是____________;
(2)①的反应类型是____________,⑦的反应类型是____________;
(3)C和D的结构简式分别为____________、____________;
(4)异戊二烯分子中最多有__________个原子共平面,顺式聚异戊二烯的结构简式为____________。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体(写结构简式)________________________________________________;
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线____________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )
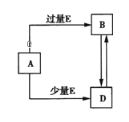
A. A、B、D可能是钠及其化合物 B. A、B、D可能是镁及其化合物
C. A、B、D可能是铝及其化合物 D. A、B、D可能是非金属及其化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液法 B.加热分解 C.结晶法 D.分液法 E.渗析法 F.蒸馏法 G.过滤法
(1)___________分离水和煤油的混合物。
(2)___________分离水和酒精。
(3)___________分离溴水中的溴和水。
Ⅱ、欲用98%的浓硫酸(g=1.84g/cm3)配制浓度为0.5mol/L的稀硫酸480ml。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平⑦药匙。
请回答下列问题:
(4)上述仪器中,在配制稀H2SO4时不需要使用的有___________(填代号),还缺少的仪器是______________________;
(5)经计算,需浓H2SO4的体积为___________;如果实验室有15mL、20mL、50mL的量筒应选用_______mL的量筒最好,量取时俯视量筒读数将使浓度__________(“偏高”、“偏低”、“无影响”);
(6)将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若未冷却至室温便将溶液转移至容量瓶会使浓度偏________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中可用如下反应制取氯气:2KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O,此反应中氧化剂与还原剂的物质的量之比为( )
A.1:8B.1:5C.2:5D.5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠元素的单质及其化合物的叙述不正确的是( )
A. 钠是银白色金属,质软,熔点相对较低,密度比水小
B. Na2O2中阴阳离子个数比为1∶1
C. 金属钠在空气中长期放置,最终变为碳酸钠
D. Na2O和Na2O2都能由金属钠和氧气化合生成,但Na2O和Na2O2中O的价态不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
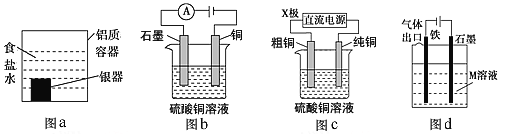
A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】组成人体细胞的主要元素是( )
A. C、H、O、N、Ca、PB. H、O、K、S、P、Mg
C. C、P、O、S、H、ND. N、P、K、Ca、S、Zn
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com