
| A. | 用明矾对自来水进行杀菌消毒 | |
| B. | 钠长期放置在空气中,最终将变成碳酸氢钠 | |
| C. | CCl4、Cl2及HF中的原子都满足最外层8电子稳定结构 | |
| D. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I |
分析 A、明矾只能净水,不能消毒;
B、钠性质活泼,常温下与氧气反应生成氧化钠,氧化钠然后与水生成氢氧化钠,最后生成碳酸钠;
C、H原子不能达到8电子结构;
D、质子数+中子数=质量数;
解答 解:A、明矾溶于水后电离出铝离子,铝离子水解出氢氧化铝胶体具有吸附功能,故明矾能净水,但不能消毒,故A错误
B、钠放置于空气中发生银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3•10H2O)→最后变成Na2CO3粉(风化),有关反应如下:4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO3•10H2O、Na2CO3•10H2O=Na2CO3,故B错误;
C、HF中的H原子不能达到8电子结构,只能达2电子的稳定结构,故C错误;
D、质子数+中子数=质量数,故质子数为53、中子数为78的碘原子中质量数为131,标在原子符号的左上角,质子数标在左下角,故原子符号为:${\;}_{53}^{131}$I,故D正确.
故选D.
点评 本题考查了明矾的用途、钠在空气中放置后的转化和原子的表示方法,难度不大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的有效成分是Ca(ClO)2 | B. | 漂白粉暴露在空气中久置后能变质 | ||
| C. | 漂白粉是由Cl2与石灰乳制得 | D. | 在使用漂白粉时应用浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某混合液中,可能大量含有的离子如下表:
某混合液中,可能大量含有的离子如下表:| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 | B. | +1 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol Na2CO3 | B. | 0.2mol Na2CO3、0.6mol NaHCO3 | ||
| C. | 1mol NaHCO3 | D. | 0.6mol Na2CO3、0.2mol NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
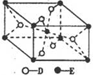 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.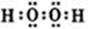 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com