
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下图所示。下列叙述正确的是

A. 有机物A可与溴水发生加成反应
B. 1mol有机物A能消耗2molNaOH
C. 有机物A不能使酸性高锰酸钾溶液褪色
D. 有机物A分子中所有碳原子可能在同一平面上
科目:高中化学 来源: 题型:
【题目】已知X、Y是主族元素,I为电离能,单位是KJ/mol.根据下表所列数据判断错误的是( )
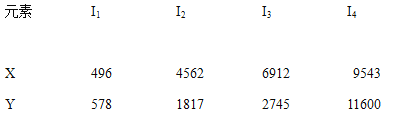
A. 元素X的常见化合价是+1价
B. 元素Y是ⅢA族的元素
C. 元素X与氯形成化合物时,化学式可能是XCl
D. 若元素Y处于第3周期,它可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量Na2CO3、NaHCO3组成的混合物溶于水配成50 mL溶液,逐滴加入稀盐酸,得到各成分物质的量变化如图所示(忽略溶液混合导致的体积变化,已知1 mol=1000 mmol)。
下列说法不正确的是
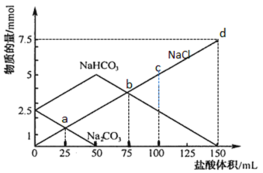
A.盐酸的物质的量浓度为0.05 mol·L-1
B.c点溶液中c(NaCl)=0.05 mol·L-1
C.a点溶液中发生反应的离子方程式为:CO![]() + H+ = HCO
+ H+ = HCO![]()
D.b点和d点所处的溶液中n(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C物质为烃类,在标准状况下的密度为1.16g/L,F物质具有水果香味,G物质不能水解。转化关系如图所示,省略了反应条件。
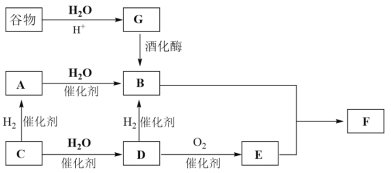
请回答下列问题:
(1)写出G的分子式:____________________。
(2)D中官能团的名称是__________________________。 C→A的反应类型____________
(3)请写出反应B+E→F的化学方程式:______________________。
(4)下列有关说法正确的是_____________________________。
A.C物质燃烧时,易产生大量黑烟 B.物质B和甘油(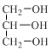 )互为同系物
)互为同系物
C.一定条件下,A可被直接氧化为D D.用NaOH溶液可以区分B、D、F
查看答案和解析>>
科目:高中化学 来源: 题型:
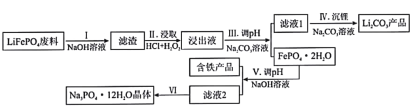
【题目】磷酸亚铁锂(LiFePO4)是目前使用量最多的一种锂电池电极材料,LiFePO4废料中(含Al、石墨)磷、铁、锂的综合回收工艺流程图:
已知:①![]() ,
,![]()
②常温下,![]() ,
,![]() ,
,![]()
(1)过程I“碱浸”的目的是____________,该过程发生反应的离子方程式为_________________。
(2)过程II“酸浸”加人双氧水的目的是_________________。
(3)①浸出液中存在大量![]() 、
、![]() 离子,从平衡移动角度解释过程Ⅲ得到磷酸铁晶体的原因_________________。
离子,从平衡移动角度解释过程Ⅲ得到磷酸铁晶体的原因_________________。
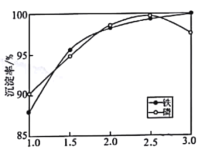
②一定条件下,探究了pH对磷酸铁沉淀的影响,结果如图所示。由图可知,过程Ⅲ应选取的最佳沉淀pH为____。随pH的增加,磷的沉淀率开始下降,而铁沉淀率未下降,分析原因为_________________。
(4)测得滤液1中c(Li+)=0.l5mol/L,某同学取该100mL滤液进行“沉锂”反应.加入50mlNa2CO3溶液却未见沉淀,若不考虑Na2CO3的水解和液体混合时的体积变化,则该同学加入的Na2CO3溶液最大浓度为c(Na2CO3)=_____________mol/L
(5)过程Ⅵ将滤液2________,________,经过滤、干燥后得Na3PO4·12H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有原子序数依次增大的A、B、C、D、E五种前四周期元素,B元素原子有三个能级,且每个能级上的电子数相等;C原子的p轨道处于半充满状态,D的单质是空气的主要成分之一,其质子数为A与C之和;E在周期表中位于ds区,且与D可形成化学式为E2D或ED的二元化合物。请回答下列问题:
(1)E元素基态原子的M能层中具有_____个能级,该元素的常见化合价有多种,其中E+的简化电子排布式为__________。
A.[Ar]3d104s1 B.[Ar]3d10 C.[Ar]3d94s1 D.[Ar]3d84s2
(2)元素C和D的原子的第一电离能较大的为__________(填元素符号),其原因是____________________;C与A可形成一种常见的气态化合物,该化合物的空间构型为____________________,其中C原子的杂化轨道类型为____________________。
(3)C2在日常生活及工农业生产等领域用途非常广泛,其分子结构中σ键和π键数目之比是_______;C2D与BD2互为__________(填“等电子体”或“非等电子体”),其理由是____________________。
(4)在E催化下,分子式为BA4D的化合物可被氧化为分子式为BA2D的化合物,则BA2D分子中键角约为__________;BA4D和BA2D两化合物均易溶于水,是由于与水分子间形成了__________键的缘故。
(5)元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为__________;元素B的单质晶体结构有多种,其中一种硬度很大,结构如下图,则该单质晶体的熔点_______E单质晶体的熔点(填“高于”或“低于”);若B单质的原子(如图中A、B两原子)在体对角线上外切,晶胞参数为a,则该晶体的空间利用率约为__________。(百分数表示,取两位有效数字)(已知![]() =1.732)
=1.732)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(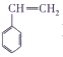 )有下列叙述,其中错误的是( )
)有下列叙述,其中错误的是( )
A.既可以与溴发生加成反应,又可以与溴发生取代反应
B.1mol苯乙烯最多可以与4mol氢气发生加成反应
C.苯乙烯分子中所有原子一定处于同一平面上
D.苯乙烯既可使酸性髙锰酸钾溶液褪色,又可使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向溴化亚铁溶液中通入过量氯气Fe2++2Br-+2Cl2=Fe3++Br2+4Cl-
B.三氯化铁溶液跟过量氨水反应Fe3++3NH3H2O=Fe(OH)3↓+3NH![]()
C.硫化亚铁与盐酸反应S2-+2H+=H2S↑
D.过量铁粉与稀HNO3反应Fe+4H++NO![]() =Fe3++NO↑+2H2O
=Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO、H2)是一种重要的化工原料气。合成气制取有多种方法,如煤的气化、天然气部分氧化等。回答下列问题:
I.合成气的制取
(1)煤的气化制取合成气。
已知:①H2O(g)=H2O(l) △H=-44kJ/mol;
②部分物质的燃烧热:
![]()
则反应C(s)+H2O(g)![]() CO(g)+H2(g)的△H=___kJ/mol。
CO(g)+H2(g)的△H=___kJ/mol。
(2)天然气部分氧化制取合成气。
如果用O2(g)、H2O(g)、CO2(g)混合物氧化CH4(g),欲使制得的合成气中CO和H2的物质的量之比为1︰2,则原混合物中H2O(g)与CO2(g)的物质的量之比为__。
Ⅱ.利用合成气合成乙醇
在一定条件下,向容积为2L的恒容密闭容器中投入2molCO和4molH2,发生反应:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)。
CH3CH2OH(g)+H2O(g)。
(1)写出该反应的平衡常数表达式__。
(2)下列情况能作为判断反应体系达到平衡的标志是__(填序号)。
A.压强不再变化 B.平均摩尔质量不再变化 C.密度不再变化
(3)反应起始压强记为p1、平衡后记为p2,平衡时H2的转化率为__。(用含p1、p2的代数式表示)
Ⅲ.合成乙醇的条件选择
为探究合成气制取乙醇的适宜条件,某科研团队对不同温度、不同Rh质量分数的催化剂对CO的吸附强度进行了研究,实验数据如图。CO的非离解吸附是指CO尚未乙醇化,离解吸附是指CO已经乙醇化。
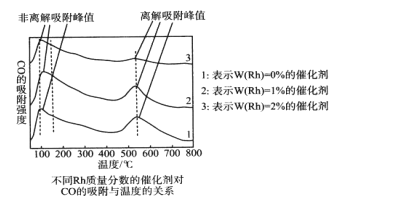
(1)结合图像从低温区、高温区分析温度对CO吸附强度的影响__;以及催化剂对CO吸附强度的影响__。
(2)用Rh作催化剂,合成气制取乙醇的适宜温度是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com